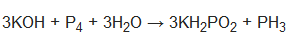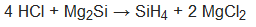Anorgaaniline keemia II KT vastused
Lisamise aeg:
2015-08-14 11:41:51Vaatamiste arv:
23777Tagasiside:
1 1KÜSIMUSED kontrolltööks
Anorgaaniline keemia II
November 2014
AATOMIEHITUS
Mida iseloomustavad kvantarvud n, l ja m? Millised on nende väärtused?
n - peakvantarv, määrab elektroni energianivoo, n = 1,2,3,4...lõpmatuseni
l- orbitaal- ehk kõrvalkvantarv; määrab elektroni energia alanivoo, orbitaali kuju, l = 0, 1, 2, 3,... n-1 (orbitaalid s, p, d, f)
m- magnetkvantarv; määrab orbitaalide arvu alanivool, iseloomustab orbitaalide orientatsiooni ruumis. m = 0, ±1, ±2, ±3,....±l
Millised järeldused tulenevad Pauli printsiibist ja Hundi reeglist (näited)?
Pauli printsiip: aatomis ei saa olla kahte (või enamat) samas kvantolekus elektroni, s.t iga elektron aatomis peab erinema mingist teisest elektronist selles aatomis vähemalt 1 kvantarvu poolest (=> orbitaalil saab olla ainult 2 elektroni)
Hundi reegel: alanivoo elektronide summaarne spinn peab olema maksimaalne (järelikult täituvad sama alanivoo orbitaalid elektronidega algul ühekaupa ja alles seejärel teise elektroniga).
Milline on s-, p- ja d-orbitaalide kuju ja milline on lainefunktsiooni (Ψ) märk nende orbitaalide erinevates osades?
Kirjutage keemilise elemendi E elektronvalem, määrake elemendi asukoht perioodilisustabelis, väliskihi elektronide ja elektronkihtide arv.
Element E: a) Se (Z = 34); b) Ti (Z = 22); c) Ag (Z = 47); d) Sr (Z = 38); jne.
a) Se: +34: 1s22s22p63s23p64s23d104p4
b) Ti: +22: 1s22s22p63s23p64s23d2
c) Ag: +47: 1s22s22p63s23p64s23d104p65s14d10
d) Sr: +38: 1s22s22p63s23p64s23d104p65s2
Mida iseloomustab keemilise elemendi efektiivne tuumalaeng Zef?
Kuidas ja miks muutub Zef perioodilisustabeli perioodides (vasakult paremale) ja
A-rühmades (ülevalt alla) üldreeglina?
Efektiivne tuumlaeng on väliskihi elektrone mõjutav tuumalaeng; 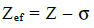 , kus σ on varjestusefekt;
, kus σ on varjestusefekt;
Perioodis vasakult paremale A-rühmade elementidel – Zef suureneb (tuumalaeng
kasvab, kuid varjestusefekt oluliselt ei muutu); B-rühmades on see muutus suhteliselt väike (mõnevõrra kasvab ka varjestusefekt).
Rühmas ülevalt alla – Zef muutub suhteliselt vähe (veidi suureneb, sest uued orbitaalid mis lisanduvad kihtide arvu kasvades on efektiivsemalt paigutunud).
Millist tüüpi aatomiraadiusi on võimalik eksperimentaalselt mõõta ja teoreetiliselt arvutada, mida need aatomiraadiused iseloomustavad?
Metalliline raadius – pool aatomituumade vahelisest kaugusest metalli kristallivõres;
Kovalentne raadius – pool aatomituumade vahelisest kaugusest lihtaine molekulis;
van der Waalsi raadius – pool aatomituumade vahelisest kaugusest kristallivõres,kui aatomid on seotud van der Waalsi jõududega (väärisgaaside korral);
Iooniraadius – määratakse ioonkristallis tuumadevahelise kauguse kaudu;
orbitaalraadius – teoreetiliselt arvutatud aatomi- või iooniraadius.
Kuidas muutub keemiliste elementide aatomiraadius perioodilisustabeli perioodides (vasakult paremale) ja A-rühmades (ülevalt alla) üldreeglina?
Võrrelge järgmiste keemiliste elementide aatomiraadiusi, põhjendage erinevust:
Na ja Al; b) Ca ja Ba; c) As ja Br; d) Cl ja I; e) S ja F; jne.
Kuidas ja miks muutub d-elementide aatomiraadius dekaadis ja rühmas ülevalt alla (üldreeglina)? Mis on lantanoidne kontraktsioon?
d-elementide aatomiraadius esialgu kahaneb, siis Mn ja Fe raadiused samad ja siis hakkavad vaikselt kasvama; efekt väga väike ja selle põhjuseks on d-orbitaalide omavahelised mõjud. Mn puhul on kõik d-orbitaalid täidetud 1 elektroniga ja d-orbitaalid omavahel väga ei tõuku; samas Zn on kõik d-orbitaalid täidetud 2 elektroniga ja d-orbitaalid tõukuvad juba rohkem, seetõttu on Zn aatomiraadius veidi suurem kui Mn oma (0,1 angströmit rohkem). Ülalt alla 4 perioodi aatomiraadiused on väiksemad kui 5 perioodi aatomiraadiused, aga 5 ja 6 perioodi aatomiraadiused on ligikaudu samad, sest 6 perioodis on lantanoidse kontraktsiooni efekt. Lantanoidne kontraktsioon toimub seetõttu, et 6 perioodis tulevad juurde uuena f-orbitaalid, mis on nõrga varjestava toimega ja seega mõjub väliskihi elektronidele suurem efektiivne tuumalaeng ning aatom on väiksem.
Kuidas on katiooni või aniooni raadius seotud selle iooni laenguga? Miks?
Võrrelge järgmiste ioonide iooniraadiusi, põhjendage erinevust: a) Ca2+ ja Ba2+;
b) N3− ja P3−; c) Na+ ja Al3+; d) N3− ja F−; e) Fe2+ ja Fe3+; f) Na+ ja Cl−; jne.
Mida iseloomustab keemilise elemendi ionisatsioonienergia I? Kuidas ja miks muutub I perioodilisustabeli perioodides (vasakult paremale) ja A-rühmades (ülevalt alla) üldreeglina?
Ionisatsioonienergia (ionisatsioonipotentsiaal), I (eV või kJ/mol) –energia, mis kulub isoleeritud aatomist ühe elektroni eraldamiseks. I1 – esimese elektroni eemaldamiseks kuluv energia, I2 – teise elektroni eemaldamiseks kuluv energia jne. I1 < I2 < I3 < I4 jne; Üleminekul eelviimase kihi elektronide eemaldamisele I järsult kasvab. Ionisatsioonienergia iseloomustab elementide metallilisi omadusi (elektroni loovutamise võimet).
Perioodis vasakult paremale – ionisatsioonienergia kasvab.
Rühmas ülevalt alla – ionisatsioonienergia kahaneb (üldreeglina), vastavalt efektiivse tuumalaengu ja aatomiraadiuse muutusele.
Kuidas ja miks muutub d-elementide ionisatsioonienergia dekaadis ja rühmas (üldreeglina)?
Esimese ionisatsiooni energiad kJ/mol
Sc633,1 |
Ti658,8 |
V650,9 |
Cr652,9 |
Mn717,3 |
Fe762,5 |
Co760,4 |
Ni737,1 |
Cu745,5 |
Zn906,4 |
Y600 |
Zr640,1 |
Nb652,1 |
Mo684,3 |
Tc702 |
Ru710,2 |
Rh719,7 |
Pd804,4 |
Ag731 |
Cd867,8 |
Võrrelge keemilise elemendi E järjestikuste ionisatsioonienergiate väärtusi (I1, I2, I3, jne.), põhjendage erinevust. Milliste I väärtuste vaheline erinevus on eriti suur? Miks?
Element E: a) K; b) Mg; c) Ga; jne.
a) K: I1<
b) Mg: I1 < I2<< I3
c) Ga: I1 < I2 < I3
Mida iseloomustab keemilise elemendi elektronafiinsus Ae? Kuidas ja miks muutub Ae perioodilisustabeli perioodides ja A-rühmades (üldreeglina)?
Elektronafiinsus, Ae või EA (eV või kJ/mol) –energia, mis eraldub või neeldub, kui isoleeritud aatom seob ühe elektroni. Teise elektroni sidumisel energia alati neeldub (efekt on endotermiline). Elektronafiinsus iseloomustab elementide mittemetallilisi omadusi (elektroni sidumise võimet).
Perioodis vasakult paremale – elektronafiinsus (eksotermiline efekt) kasvab.
Rühmas ülevalt alla – elektronafiinsus kahaneb (üldreeglina), vastavalt efektiivse tuumalaengu ja aatomiraadiuse muutusele.
Kuidas on ionisatsioonienergia ja elektronafiinsuse väärtused seotud elemendi metalliliste või mittemetalliliste omadustega (põhjendage vastust)?
Reastage alltoodud keemilised elemendid järgmiste füüsikaliste suuruste kasvu järgi: : • aatomiraadius, • iooniraadius, • ionisatsioonienergia, • elektronafiinsus (põhjendage vastust): a) Na, P ja Cl; b) Mg, Ca ja Ba; c) Se, Cl ja Br; jne.
aatomiraadius |
iooniraadius |
ionisatsioonienergia |
elektronafiinsus |
|
a) |
Na > P > Cl |
P3->Cl->Na+ |
I1(Cl)>I1(P)>I1(Na) |
EA(Cl)>> EA(P)> EA(Na) |
b) |
Ba > Ca > Mg |
Ba2+> Ca2+> Mg2+ |
I1(Mg)>I1(Ca)>I1(Ba) |
EA(Mg)> EA(Ca)> EA(Ba) |
c) |
Cr > Se > Br |
Se2-> Cl- > Cr3+ |
I1(Cl)>I1(Se)>I1(Cr) |
EA(Cl)> EA(Se)> EA(Cr) |
Millega on määratud keemilise elemendi oksüdatsiooniaste ühendis? Miks seda nimetatakse formaalseks suuruseks?
Keemilise elemendi oksüdatsiooniaste ühendis on määratud elemendi väliskihi elektronide arvuga (d-elemendid saavad loovutada ka eelviimaselt kihilt)
Nimetatakse formaalseks suuruseks, sest reaalselt ei ole sidemed nii ioonilised ja aatomid jagavad omavahel elektronipaari,
Oksüdatsiooniaste – elemendi aatomi formaalne laeng ühendis, eeldusel, et aatomite vahel on ainult ioonilised sidemed (eeldades ühiste elektronipaaride täielikku üleminekut elektronegatiivsema elemendi aatomile).
Määrake keemiliste elementide oksüdatsiooniastmed järgmistes ühendites: a) Na2O2; b) SiH4; c) KCN; d) FeS2; e) (NH4)2Cr2O7; f) Na2SO3S; g) KPH2O2; jne.
a) Na2O2: Na: +I; O: -I
b) SiH4: Si: +IV; H: -I
c) KCN: K: +I; C: +2; N: -III
d)FeS2: Fe: II; S2: -II
e) (NH4)2Cr2O7: N: -III; H: +I; O: -II; Cr:+VI
f) Na2SO3S: Na: +I; S1: VI; S2: -II; O: -II
g) KPH2O2: K: +I; P: +I; O: -II; H: +I 
Millega on määratud A-rühmade keemiliste elementide võimalikud oksüdatsiooniastmed ühendites? Kuidas ja miks muutub A-rühmade metalliliste elementide maksimaalse oksüdatsiooniastme püsivus rühmas ülevalt alla?
s-elementide (I-A ja II-A rühma elementide) oksüdatsiooniaste ühendites – võrdub rühma
numbriga (väliskihi elektronide arvuga).
p-elementide (III-A ja VII-A rühma elementide) maksimaalne oksüdatsiooniaste ühendites – võrdub rühma numbriga (väliskihi elektronide arvuga).
Metallilistel p-elementidel muutub rühmas ülevalt alla stabiilsemaks maksimaalsest
oksüdatsiooniastmest kahe võrra väiksem oksüdatsiooniaste – s.t sidemete moodustamiseks
kasutatakse ainult väliskihi p-elektrone, mitte s-elektrone (nn inertpaari efekt).
Millega on määratud siirdemetallide võimalikud oksüdatsiooniastmed ühendites? Kuidas ja miks muutub maksimaalse oksüdatsiooniastme ning oksüdatsiooni-astme II püsivus dekaadis ja rühmas ülevalt alla?
d-elementide (siirdemetallide) 1. alaperes (III-B – VII-B rühmas) – maksimaalne oksüdatsiooniaste võrdub rühma numbriga, kuid muutub perioodis vasakult paremale järjest ebastabiilsemaks (maksimaalse o-a ühendi oksüdeerivad omadused tugevnevad).
2. alaperes (VIII-B, I-B ja II-B rühmas) perioodis vasakult paremale – maksimaalne
oksüdatsiooniaste üldreeglina kahaneb. (stabiilne on kõigil o-aste +II, va vb Fe). Oksüdatsiooniastmete püsivus võib sõltuda ka keskkonnast – happeline keskkond soodustab kõrgemas oksüdatsiooniastmes ühendite üleminekut madalamasse oksüdatsiooniastmesse (tugevdab oksüdeerivaid omadusi).
Rühmas ülevalt alla muutuvad d-elementidel stabiilsemaks kõrgemad oksüdatsiooniastmed
(üldreeglina), sest kõrgem oksüdatsiooniaste tähendab rohkem keemilisi sidemeid ja kuna elektronide loovutamise energia teevad tasa tekkinud keemiliste sidemete energiad.
Kirjutage keemilise elemendi E elektronvalem, määrake elemendi asukoht perioodilisustabelis, väliskihi elektronide ja elektronkihtide arv. Iseloomustage selle elemendi aktiivsust metalli või mittemetallina. Millised on selle elemendi tüüpilised oksüdatsiooniastmed ühendites (näited vastavatest ühenditest)?
Element E: a) Se (Z = 34); b) Ti (Z = 22); c) Ag (Z = 47); d) Sr (Z = 38); jne.
a) Se: elektronvalem: Se: +34: 1s22s22p63s23p64s23d104p4; asukoht per tabelis 4. Periood VIA rühm; Aktiivsus ja keemilised omadused on sarnased väävliga. Väliskihi el arv on 6, elektronkihtide arv on 4.Seleeni tüüpilised oksüdatsiooniastmed ühendites on II- (K2S), O (Se∞,), II (SeCl2 ), IV(K2SeO3 ), VI (SeO 3; SeF6);, Se ei reageeri vee ega lahj hapetega;
b) Ti: +22: 1s22s22p63s23p64s23d2; asukoht per tabelis 4 periood; IVB rühm, väliskihis on 2 elektroni, saab kasutada ka eelviimase kihi d-elektrone; stabiilne oksüdatsiooniaste on IV(rutiil TiO2); kuid leidub ka Ti(II) ja Ti(III) ühendeid. Kuumutamisel reageerib Ti hapnikuga ja halogeenidega; tugeval kuumutamisel ka lämmastikuga; lämmastikhappes passiveerub, üldiselt keemiliselt püsiv. Kuumutamisel lahustub Ti soolhappes, moodustades Ti(III)akvakomplekse [Ti(OH2)6]3+
c) Ag: +47: 1s22s22p63s23p64s23d104p65s14d10; tavatingimustel ei reageeri, kuigi elektronafiinsus on üsna suur; tüüpiline (ainus stabiilne) oksüdatsiooniaste ühendites on I, AgNO3; väga püsiv on ka hõbeda ammiinkompleks [Ag(NH3)2]+; seetõttu lahustuvad lahustumatud hõbedaühendid paremini ammoniaagi juuresolekul.
d) Sr: +38: 1s22s22p63s23p64s23d104p65s2; tüüpiline o-a on II, Sr(OH)2 reageerib aktiivselt juba külma veega ja tavatingimustel aktiivsemate õhu koostisosadega.
KEEMILINE SIDE
Millega on määratud keemilise sideme pikkus? Kuidas ja miks muutub sideme pikkus reas: F2 → Cl2 → Br2 → J2?
Keemilise sideme pikkus on määratud aatomituumade vahelise kaugusega ja see on see kaugus, mis vastab energia-tuumadevaheline kaugus diagrammil energiamiinimumile. (tõmbejõud maksimaalsed, tõukejõud minimaalsed). Sideme pikkus sõltub suuresti ka aatomite enda raadiustest, mida suuremad on aatomite raadiused, seda pikem side ja mida pikem side, seda nõrgem side.
Reas F2 → Cl2 → Br2 → J2 sideme pikkus kasvab, sest aatomiraadiused kasvavad.
Mis on sideme energia? Kuidas ja miks muutub keemilise sideme energia reas: CH4 → SiH4 → GeH4 → SnH4?
Keemilise sideme energia on energia, mis vabaneb keemilise sideme tekkel (või tuleb kulutada sideme lõhkumiseks). Sideme lühenedes sideme energia kasvab ehk side muutub tugevamaks, seega rühmas ülalt-alla side samatüübilistes ühendites nõrgeneb.
Reas SiH4 → GeH4 → SnH4 sideme energia väheneb ja side pikeneb, sest aatomiraadiust poolest Si
Millega on määratud keemilise elemendi maksimaalne kovalents? Milline on järgmiste keemiliste elementide maksimaalne kovalents: a) N; b) B; c) Si; d) S? Miks?
Keemilise sideme maksimaalne kovalents on määratud valentsorbitaalide arvuga aatomis.
a) N: 4; b)B: 4; c) Si: 6; d)S: 6; sest II perioodi elementidel on väliskihis orbitaale 4 ja seega II perioodi elemendid saavad anda maksimaalselt 4 kovalentset sidet. III perioodi elemendid saavad kovalentse sideme moodustamiseks kasutada ka kahte vaba d-orbitaali, seega nende maksimaalne kovalents on 6.
Miks ei saa heelium ega neoon moodustada keemilisi ühendeid, kuid teistel väärisgaasidel on see võimalik?
Sest nii heeliumil kui ka neoonil on kõik valentsorbitaalid (He-> 1s ja Ne-> 2s ja 2p) juba elektronidega täidetud ning nendel pole ka täitmata valentsorbitaale (d-orbitaale)
Mille poolest erineb doonor-aktseptorside tavalisest kovalentsest sidemest? Tooge näiteid sideme moodustumisest doonor-aktseptormehhanismi järgi.
Doonor-aktseptormehhanismis annab doonor sideme moodustamiseks kahe elektroniga täidetud orbitaali ja aktseptor annab sideme moodustamiseks tühja orbitaali.
Näiteks H+ ja :NH3 kus lämmastik on doonor ja prooton aktseptor.
Miks kovalentne side on küllastatav, iooniline side aga mitte?
Sest kovalentne side moodustub orbitaalide kattumisel, aga orbitaale on aatomitel piiratud arv. Iooniline side põhineb elektrostaatilisel tõmbumisel ja seega Coulomb’i seadusel, mille põhjal võib tõmbuvaid laenguid olla piiramatu hulk (ainult aatomi ümber oleva ruumi hulk piirab).
Miks kovalentne side on suunaline, iooniline side aga mitte?
Kovalentne side on suunaline, sest orbitaalidel on kindel kuju ja suund (va s-orbitaal, mis on kerakujuline). (sidet moodustavad orbitaalid on reeglina suunalised ja saavad teise aatomi orbitaaliga kattuda ainult kindlas suunas)
Selgitage σ- ja π-sideme teket. Millised orbitaalid saavad neid sidemeid moodustada? Miks üksikside on alati σ-side?
Üksikside on alati sigma-side, sest sigma-side on tugevam (kattumise suurem)kui pii-side. Sigma sideme korral toimub orbitaalide kattumine tuumadevalisel sirgel; pii-sideme korral kattumine 2 piirkonnas:all ja ülalpool tuumadevahelist sirget. Pii-sidet ei saa anda s-orbitaalid, aga saavad anda p-orbitaalid.
Kuidas ja miks mõjutab keemilise sideme kordsus keemilise sideme pikkust ja tugevust (sideme energiat)?
Mida suurem kordsus, seda lühem ja tugevam on keemiline side, sest kattumine on suurem.
Mis on hübridisatsioon? Millistel tingimustel see toimub? Kuidas hübridisatsiooni esinemine mõjutab keemiliste sidemete tugevust?
Hübridisatsioon on 1 ja sama aatomi eri tüüpi orbitaalide ühtlustumine (hübridiseerumine) σ-sidemete moodustumisel (σ-sidemeid moodustavad hübriidsed ehk ühtlustunud orbitaalid). Hübridisatsiooni tõttu sidemeenergia kasvab ja hübridisatsioonis võib osaleda ka orbitaal, millel asub vaba elektronipaar. Vaba elektronipaar avaldab sidet moodustavatele elektronipaaridele suuremat tõukejõudu, kui sidet moodustavad elektronipaarid omavahel. Hübridisatsiooni tugevdab delokaliseeritud π-sideme teke.
Hübridisatsiooni tingimused:
Hübridiseeruvad orbitaalid on suhteliselt lähedase energiaga
Moodustuvate keemiliste sidemete energia on piisavalt suur
Kumma molekuli või iooni korral on hübridisatsioon tugevam (põhjendage vastust): a) NH3 ja PH3; b) SiCl4 ja SiH4; c) SiO44– ja SO42–?
a) NH3 puhul on tugevam hübridisatsioon, sest N-aatomi s ja p orbitaalid on lähedasema energiaga kui P s ja p obritaalid. (Samuti hübridiseeruvad tugevamini väiksemate aatomite orbitaalid)
b) SiCl4 hübridiseerub tugevamini, sest kuna Si ja Cl aatomiraadiused on sarnasemad kui H ja Cl, siis moodustuvate keemiliste sidemete energia on suurem.
Miks on sidemetevaheline nurk NH3 molekulis (~107o) lähedane tetraeedrilisele (~109o), kuid SbH3 korral lähedane täisnurksele (90o)?
Sest ammoniaagis on lämmastik on hübridiseerunud orbitaalidega, antimonhüdriid aga ei ole, sest antimoni väliskihi s ja p orbitaalide erinevus on suur ja hübridiseerumine ei ole soodustatud.
Milline on järgmiste molekulide ja ioonide kuju (selgitage struktuurivalemitega)? Millistes nendest esineb hübridisatsioon? Milline? BCl3, CS2, C2H2, SiCl4, SiCl62−, NH3, NH4+, NO2−, PCl5, H2O, H2Se, SO42− jne?
BCl3 – sp2- planaarne trigonaalne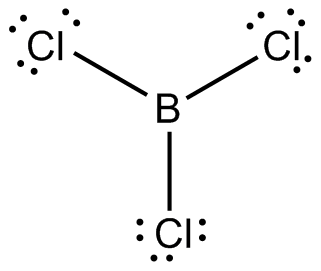 on hübridisatsioon
on hübridisatsioon
CS2- sp 
C2H2- sp hübridisatsioon
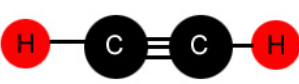
SiCl62—sp3d2 hübridisatsioon 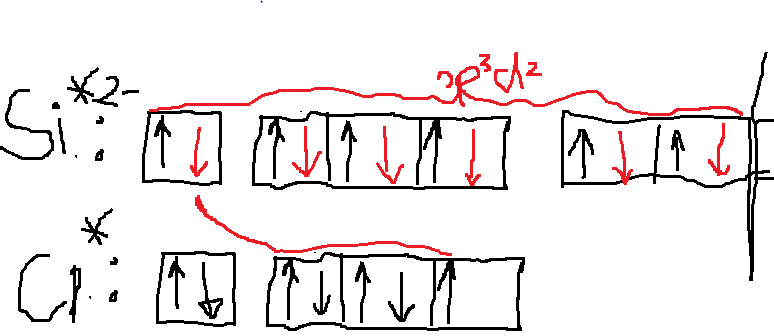
NO2- sp2 hübridisatsioon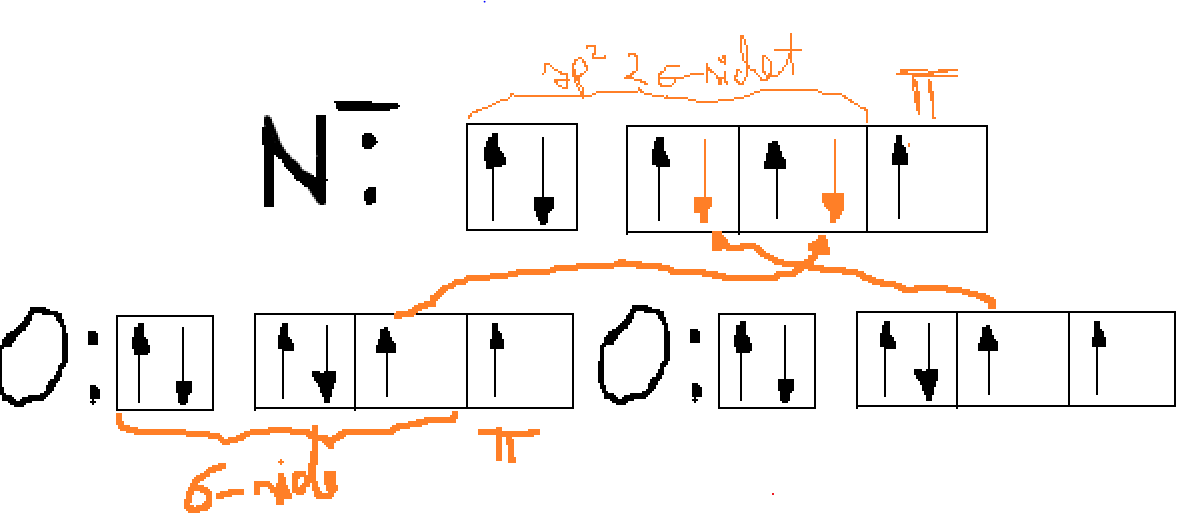
PCl5 sp3d hübridisatsioon 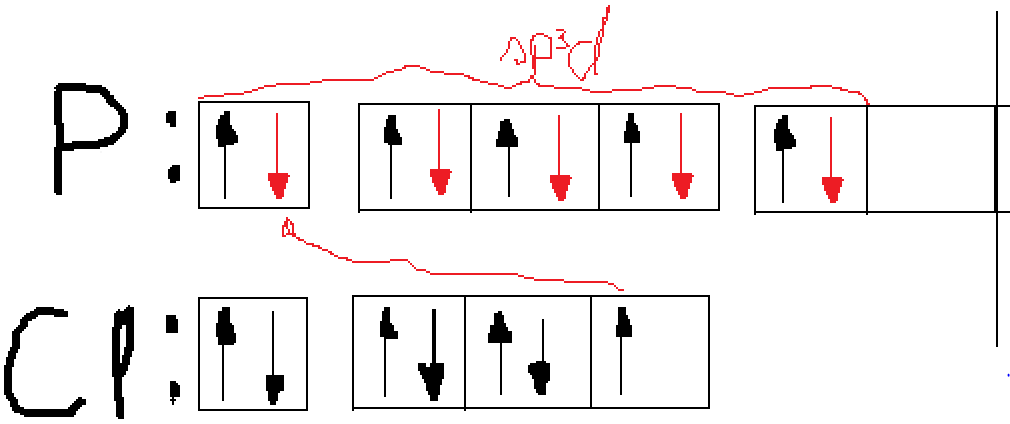
H2Se- ei ole hübridisatsiooni (praktiliselt); H-Se-H nurk on 91°
SO42-- 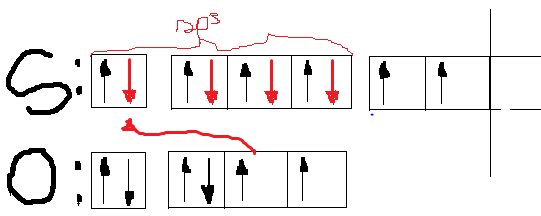 sp3 hübridisatsioon, kaks pii-sidet on laiali määritud/jagamisel 4 O vahel
sp3 hübridisatsioon, kaks pii-sidet on laiali määritud/jagamisel 4 O vahel
Mis on delokaliseeritud π-side? Millistel tingimustel see tekib (selgitage näidetega)? Millistes järgmistest molekulidest või ioonidest esineb delokaliseeritud π-sidemeid: H2O, HNO3, NH4+, SO3, C2H2, SO42− jne?
Delokaliseeritud π-side on π-side, mis ühendab enam kui kahte aatomit, ehk sideme moodustumise suunaga ristiolev p- või d-orbitaal saab kattuda mitme naaberaatomi samasuunalise p- või d- orbitaaliga.
Delokaliseeritud π-side esineb: NO3-, SO42-,
Miks grafiit juhib hästi elektrit, kuigi süsinik on mittemetalliline element?
Grafiidis on π-side delokaliseerunud üle kogu makromolekuli ja elektronide jaotud sellel sarnaneb metallises oleva elektrongaasiga (vähemalt mööda kihti)
Mis on elektronegatiivsus? Kuidas ja miks muutub keemiliste elementide elektronegatiivsus perioodilisustabeli perioodides ning rühmades?
Elektronegatiivsus on elemendi aatomi võime tõmmata enda poole ühist elektronipaari.
Kasvab floori suunas, B-rühmades pigem rühmas ülalt alla
Paulingi skaalas leitakse elektronegatiivsus ioonilisuse määra järgi (elemendi aatomi osalaengu) kaugu vastavad ühendis; Mullikeni skaalas leitakse elektronegatiivsus ionisatsioonienergia ja elektronafiinsuse poolsummana (aritm keskmine).
Kuidas mõjutab keemiliste elementide elektronegatiivsuste erinevus keemilise sideme polaarsust?
Mida suurem on elektronegativsuste erinevus, seda suurem on polaarsus.
Millega on määratud molekuli polaarsus? Millised järgmistest molekulidest ja ioonidest on polaarsed (põhjendage vastust): BeH2, BCl3, CS2, CHCl3, C2H4, HCN, SCN−, SiCl4, SiCl62−, NH3, NH4+, NO2−, NO3−, PCl5, PO43−, H2O, H2Se, SO2, SO3, SOCl2, SO32−, SO42− jne?
Molekuli polaarsus on määratud aatomite osalaengutega (ehk aatomite elektronegatiivuste erinevusega) ja aatomitevahelise kaugusega. Samuti on oluline molekuli kuju-> kui molekuli sees on sidemete dipoolmomendid suured, aga võrdsed ja vastassuunalised, siis kokku on tegemist ikkagi mittepolaarse molekuliga. St molekuli dipoolmoment võrdub sidemete dipoolmomentide summaga (ja sidemete dipoolmomendid on vektorsuurused).
BeH2 on mittepolaarne, sest Be-aatomil on sp-hübridisatsioon ja => lineaarne molekul, kus sidemete dipoolmomentide summa on 0
BCl3 sp2- hübridisatsioon,Cl-aatomid on B aatmi ümber sümmeetriliselt ja sidemete dipoolmomendid taanduvad 0-ks => mittepolaarne molekul.
CS2 – C-aatomil sp-hübridisatsioon; laengujaotus sümmeetriline, mittepolaarne;
CHCl3- polaarne (vähe); C2H4- mittepolaarne; HCN- polaarne; SCN- – polaarne; SiCl4- mittepolaarne; SiCl62- - mittepolaarne
SO2- polaarne; sest molekul on nurkjas (S-aatomile jääb vaba elektronpaar, mis tõukub S=O sidemetega)
SO3- ei ole polaarne; sümmeetriline;
SOCl2- polaarne; SO32- on polaarne, vaba elektronpaar S-aatomil muudab molekuli ebasüm tetragunaalseks.
Kuidas mõjutab keemilise sideme ioonilisust (polaarsust) katioonide polariseeriv toime anioonidele? Miks on katioonide korral määravam nende polariseeriv toime, anioonidel aga polarseeritavus?
Kui katiooni polariseeriv toime anioonidele on tugev, siis sideme polaarsus väheneb Katioonide puhul on määravam nende polariseeriv toime, sest nende mõõtmed on reeglina väiksemad sama laenguhulga juures võrreldes anioonidega. Anioonidel on siis suuremad mõõtmed sama laenguhulga korral ja need on üldiselt paremini polariseeritavad
Millised tegurid ja kuidas mõjutavad katioonide polariseerivat toimet ning anioonide polariseeritavust (Fajansi reeglid)? Põhjendage vastust.
Katiooni polariseeriv toime anioonile on seda tugevam, mida suurem on katiooni elektrontihedus, s.t mida suurem on katiooni laeng ja väiksemad tema mõõtmed.
Anioon on seda polariseeritavam, mida suurem on aniooni laeng ja mida suuremad tema mõõtmed (mida suurem ja hõredam on aniooni elektronpilv).
Siirdemetallide (d-metallide) katioonide polariseeriv toime anioonidele on tugevam kui Arühmade (s- ja p-metallide) katioonidel, sest siirdemetallide katioonide efektiivne tuumalaeng on suurem (eelviimase kihi d-alakihi varjestav toime on nõrgem kui s- ja p-alakihtidel)
Reastage järgmised ühendid keemilise sideme ioonilisuse (polaarsuse) kasvu suunas (põhjendage vastust): MgCl2, AuCl3, KCl, CrCl2, CsCl, CrCl3, NiCl2.
AuCl3 -> CrCl3 -> NiCl2 ~ CrCl2-> MgCl2 -> KCl -> CsCl
Mida väiksem ja suurema laenguga on katioon, seda kovalentsem on side. Samuti on tugevam mõju d-metallidel.
Kuidas tekib vesinikside? Kuidas mõjutavad vesiniksidemed ainete füüsikalisi ja keemilisi omadusi? Millistes järgmistest ainetest saavad moodustuda vesiniksidemed: H2O2, CH3F, H2, NH3, H2S, HNO3, SiH4, H3PO4 jne?
Vesinikside – täiendav side, mille võib piisavalt suure positiivse osalaenguga vesiniku aatom moodustada mõne lähedalasuva elektronegatiivse elemendi aatomiga (selle vaba elektronipaariga). Vesinikside on kovalentsest sidemest pikem ja nõrgem.Tekib peamiselt ühendites, kus vesiniku aatom on seotud fluori, hapniku või lämmastiku aatomiga (suhteliselt nõrga vesiniksideme saab moodustada ka kloori või väävli aatomiga seotud vesiniku aatom). Vesinikside võib olla molekulidevaheline (intermolekulaarne) või molekulisisene (intramolekulaarne).
Molekulidevahelised vesiniksidemed mõjutavad oluliselt ainete omadusi – sulamis- ja
keemistemperatuuri, lahustuvust
Miks on vesi tavatingimustes vedelas olekus, ammoniaak ja vesinikfluoriid aga gaasilises, kuigi neis kõigis esinevad molekulidevahelised vesiniksidemed?
Selgitage struktuurivalemite abil vesiniksidemete teket järgmiste ainete molekulide vahel: a) NH3 ja H2O; b) HF ja H2O; c) H2S ja H2O.
Millised on molekulidevaheliste füüsikaliste (Van der Waalsi) jõudude alaliigid? Kuidas nende jõudude tugevus sõltub temperatuurist ja aine iseloomust? Põhjendage vastuseid.
Füüsikaline (elektrostaatiline) vastastiktoime osakeste vahel; seejuures on osakeste-vaheline kaugus suurem ja jõud oluliselt nõrgemad kui keemilise sideme korral. Vastastiktoime on mitteküllastatav ja mittesuunaline.
Liigitus:
Orientatsioonijõud- dipoolide (polaarsete molekulide) vastastiktoime; avaldub kõige tugevamini väikeste, tugevalt polaarsete osakeste vahel.Orientatsioonijõud sõltuvad oluliselt temperatuurist (soojusliikumise tugevnemisel orientatsioonijõud nõrgenevad).
induktsioonijõud – dipoolide ja indutseeeritud dipoolide vastastiktoime, avaldub tugevamini hästipolariseeritavate ainete korral. Esineb näiteks polaarsete ja mittepolaarsete osakestega ainete segudes (nt. klatraadid). Induktsioonijõude tugevus ei sõltu temperatuurist.
dispersioonijõud – hetkeliste, sünkroonselt tekkivate dipoolide vastastiktoime. Dispersioonijõud tugevnevad osakeste polariseeritavuse kasvamisel (s.t osakeste mõõtmete kasvamisel); kõige olulisemad on nad mittepolaarsete osakestega ainete korral, kus orientatsioonijõude ei esine. Dispersioonijõude tugevus ei sõltu temperatuurist, hetkeliste dipoolide teke on palju kiirem osakeste soojusliikumisest.
vdW jõudude tugevus on seotud aine agreaatolekuga- mida tugevam on osakestevaheline vastastiktoime, seda kõrgem on aine sulamis- ja keemistemperatuur.
Kuidas ja miks muutub järgmiste ainete reas: a) keemilise sideme pikkus, b) keemilise sideme tugevus, c) keemilise sideme polaarsus, d) molekuli polariseeritavus, e) aine keemistemperatuur? Ained: H2O → H2S → H2Se → H2Te.
a) keemilise sideme pikkus kasvab
b) -//- tugevus väheneb
c) -//- polaarsus väheneb
d) molekuli polariseeritavus suureneb
e) H2O-l on teistest tunduvalt kõrgem kt, sest H-sidemed; teiste puhul madalam kt, aga vaikselt kasvab, sest polariseeritavus suurem ja vdW jõud tugevamad
Miks on CO2 tavatingimustes gaas, SiO2 aga väga kõva kristalne aine, kuigi need ühendid on valemi poolest sarnased ja süsinik ning räni asuvad perioodilisustabelis samas rühmas?
III periood pii-sidemed ei ole enam stabiilsed ja veel see, et räni aatomi ümber mahub paremini 4 hapnikku ära
Määrake keemilise sideme tüüp järgmistes ainetes (mittepolaarne kovalentne, polaarne kovalentne, ioonilis-kovalentne, iooniline, metalliline). Ained: LiF, Al2O3, HCl, Na, C(grafiit), BaO, NO, SnCl4, I2, AsH3.
LiH- ioonilis-kovalentne; Al2O3- ioonilis-kovalentne; HCl- polaarne kovalentne; Na- metalliline; C- mittepol kovanentne ja vdW; BaO iooniline; NO polaarne kovalentne; SnCl->iooniliskovalentne; I2- mittepolaarne-kovalentne; AsH3 –(väga vähe) polaarne kovalentne
Määrake järgmistes ainetes esineva keemilise sideme liik (mittepolaarne või polaarne kovalentne, ioonilis-kovalentne, iooniline, metalliline) ja kristallivõre tüüp (ioonvõre, molekulvõre, metallivõre, aatomvõre, koordinatsioonivõre). Millised nendest ainetest on molekulaarsed, millised mittemolekulaarsed? Ained: P4O10, SiO2, CaO, SiC(karborund), KCl, Ar, N2, C(teemant), P4, Li, I2, Al2O3.
P4O10- polaarne kovalentne; aatomvõre; mittemolekulaarne
SiO2 – polaarne kovalentne; aatomvõre; mittemolekulaarne(koordinatsioonivõre)
CaO – iooniline; mittemolekulaarne; ioonvõre
SiC – polaarne (vähe) kovalentne; aatomvõre, mittemolekulaarne
KCl- iooniline, ioonvõre; mittemolekulaarne
Ar- vdW jõud; molekulvõre
N2 – mittepolaarne kovalentne; molekulvõre; molekulaarne
C (teemant)- mittepol kovalentne, aatomvõre, mittemolekulaarne;
P4 – mittepol kov; molekulvõre, molekulaarne
Li – metalliline, metallivõre; mittemol
I2 – mittepol kovalentne, molekulaarne; molekulvõre
Al2O3 – iooniliskovalentne; aatomvõre; koordinatsioonivõre;
Millist tüüpi (energeetiliselt olulisemad): sidemed katkevad järgmistes protsessides: a) (vedela) ammoniaagi keemine; b) naatriumi lõikamine; c) “kuiva jää” (tahke CO2) sublimeerumine; d) parafiini sulamine; e) NaCl kristalli lahustumine vees; f) vee elektrolüüs; g) kvartsikristalli purustamine; h) jää sulamine; i) joodi reageerimine vesinikuga?
a) vesiniksidemed;
b) metallilised sidemed
c) vdW jõud; dispersioonijõud
d) vdW dispersioonijõud
e) ioonilised sidemed
f) kovalentsed sidemed
g) kovalentsed sidemed
h) osa vesiniksidemeid
i) mittepol kov sidemed
Millised on molekulorbitaalide meetodi põhierinevused võrreldes valentssidemete meetodiga?
Valentssidemete meetodi aluseks on väide, et aatomitevaheline side molekulis tekib ühiste elektronipaaride abi ja kõik teised elektronid aatomis säilitavad oma oleku.
VS meetodi abil ei saa tõesada, et hapnik on paramagneetiline-> hapnikul 2 kolmeelektroonset sidet; lisaks igasugused elektronidefitsiidiga ühendid nagu boraanid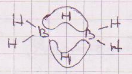
Molekulorbitaalide meetodi korral vaadeldakse molekuli (kompleksi) kui ühtset tervikut, milles kõik elektronid on ühised kogu molekulile (kompleksile). Kui igale elektronile aatomis vastab aatomorbitaal, siis vastab igale elektronile molekulis molekulorbitaal. Keemilise sideme kirjeldamiseks molekulis vaadeldakse MO-meetodi korral elektronide jaotust molekulorbitaalidel. Molekulorbitaalid on paljutsentrilised.
MO-meetodis ei ole vaja mõisteid nagu hübriidsed orbitaalid või konjugeeritud side.
Tingimused MO-tekkeks:
Aatomiorbitaalide kattumine peab olema piisav
Nende aatomiorbtaalide energiad peavad olema lähedased
Aatomiorbitaalide sümmeetria peab omavahel sobima
Selgitage siduvate ja lõdvendavate molekulorbitaalide teket orbitaalide σ- ja π-sümmeetria korral (joonised). Millisel juhul tekivad mittesiduvad molekulorbitaalid?
Siduv tekib siis, kui kattuvad + ja + pool aatomite aatomorbitaalidest; lõdvendav siis, kui kattuvad + ja – pool.
Mittesiduv siis kui mingisugust kattumist ei ole
Kujutage järgmiste osakeste (molekulide või molekulaarsete ioonide) energiadiagrammid MO-meetodi põhjal. Milline on nendes sideme järk? Millised neist on diamagnetilised, millised paramagnetilised? Osakesed: H2, H2−, Li2, B2, B2+, C2, N2, N2+, O2, O2−, O22−, F2, Ne2+.
B, C ja N puhul on energiadiagrammi joonistamisel p-orbitaalidest moodustunud molekulorbitaalide järjekord: πp; σp; πp*; σp*
Ülejäänud elementide korral σp; πp; πp*; σp*
KOMPLEKSÜHENDID
Mille poolest erinevad kompleksühendid nn. lihtsatest ühenditest?
Nendes on osa sidemeid tekkinud doon-akts.meh. ja keskne element on moodustanud rohkem sidemeid kui on tema tavapärane oksüdatsiooniaste lubab.
Millised osakesed saavad käituda kompleksimoodustajana, millised ligandidena?
Kompleksmoodustajana saab osaleda see millel on vabad elektronorbitaalid, ligandidena need millel on elektronpaar.
Selgitage keemilise sideme iseloomu: a) kompleksimoodustaja ning ligandide vahel; b) kompleksi sisesfääri ning välissfääri vahel.
a) kovalentne; b) iooniline
Kuidas liigitatakse kompleksühendeid sisesfääri laengu, ligandide tüübi ja kompleksühendi happe-aluse iseloomu järgi (näited)?
Sisesfääri laengu järgi:
kompleks katioonid ([Cu(NH3)4]2+)
kompleks anioonid [Co(NO2)4(NH3)2]-
neutraalsed kompleksid [Fe(CO)5]
Ligandide järgi: akvakompleksid ([Cr(H2O)6]3+), klorokompleksid (H2[CuCl2]), ammiinkompleksid ([Co(NH3)6]Cl3), hüdroksokompleksid Na3[Al(OH)6]
Happeline ja aluseline – välissfääris H => happeline; välissfääris OH-=> aluseline.
Miks on komplekskatiooniga alused ja kompleksaniooniga happed tugevamad kui vastavate lihtsate ioonidega happed ja alused?
Tavalistes alustes ja hapetes on sidemed tugevamalt kovalentsed. Kompleksides on rohkem ioonilist. Sisesfääris on ligandidega sidemed väga tugevad, seetõttu välisfääriga nõrk ning kerge loovutada ioone. H2[SiF6], [Cu(NH3)3]OH2
Kirjutage ühe komplekskatiooni, ühe kompleksaniooni ja ühe neutraalse kompleksi valem ning nimetus, määrake nendes kompleksimoodustaja koordinatsiooniarv ja sisesfääri laeng.
kompleks katioon:
[Cu(NH3)4]SO4 : tetraammiinvask(II)sulfaat
[Ni(NH3)6]Br2 : heksaammiinnikkel(II)bromiid
kompleks anioonid
Na3[Co(NO2)4CO3]- naatriumkarbonetotetranitrokobaltaat(III)
Aluminaat, auraat, berüllaat; hüdrogenaat;
neutraalsed kompleksid
[Fe(CO)5] pentakarbonüülraud
Tooge näide ühe akvakompleksi, ühe hüdroksokompleksi ja ühe ammiinkompleksi saamisvõimaluse kohta.
Vesilahustes seostuvad enamiku metallide katioonid tugevasti vee molekulidega => ei esine katioonid vesilahustes kunagi nö vabal kujul, vaid akvakompleksidena. [Al(H2O)6]3+, [Fe(H2O)6]3+, [Zn(H2O)4]2+. Akvakompleksid tekivad veevabade soolade lahustumisel vees.
Hüdroksokompleksid tekivad amfoteersete hüdroksiidede reageerimisel leelisega. Näiteks Zn, Al, hüdroksokomplekse saab selle metallisoolale leelise lisamisel. Reaktsioon kulgeb astmeliselt. Leelise lisamisel lahusele tekib algul hüdroksiidi sade, kuid leelise edasisel lisamisel sade kaob hüdroksokompleksi tekke tõttu (hüdroksokompleks, erinevalt hüdroksiidist, lahustub vees hästi).
Hüdroksokompleksid tekivad ka mõnede metallide (tuntumad nendest on Zn ja Al) reageerimisel leelistega.
Paljude siirdemetallide (Co, Ni, Cu, Zn, Ag jt.) katioonid, mis vesilahuses esinevad akvakompleksidena, moodustavad lahusele ammoniaakhüdraadi (NH3×H2O) lisamisel küllaltki püsivaid ammiinkomplekse (tingimusel, et NH3×H2O kontsentratsioon lahuses on piisavalt suur). Reaktsioon toimub astmeliselt. Ammoniaakhüdraadi järk-järgulisel lisamisel lahusele sadeneb esmalt vastav hüdroksiid (sest keskkond muutub ammoniaakhüdraadi lisamisel aluseliseks). Ammoniaakhüdraadi edasisel lisamisel hüdroksiidi sade kaob ammiinkompleksi tekke tõttu (ammiinkompleksid lahustuvad vees hästi).
Millised tegurid mõjutavad kompleksimoodustaja koordinatsiooniarvu (näited, põhjendused)?
Mõjutab see, kui palju on vabasid orbitaale, millised on mõõtmed, laeng (mida suurem, seda kõrgem kordarv, suurem laeng tõmbab elektrone paremini ligi) Kui ligandid neutraalsed siis koordinatsiooniarv üldiselt suurem.
Suurus (mõõtmed)- f-elementidel või ka olla kuni 12 ligandi; laeng, kompleksimoodustaja elektronstruktuur;
Mida suurem on tsentraalaatom, seda suuremad võivad olla selle koordinatsiooniarvud
Kui tsentraalaatomil on suurm oks-aste, siis võib koord arv olla suurem
Üldreeglina mitmehambaliste ligandide puhul jääb ligandide arv vähemaks
Mõjutab ka tsentraalaatomi elektronistruktuur
Millised on iseloomulikud koordinatsiooniarvud kompleksühendites? Millise kujuga kompleksid neile vastavad ja milline hübridisatsioon nendes esineb?
Kõige tüüpilisemad on 6 ja 4.
Koordinatsiooniarvule 6 vastab oktaeedriline kuju; hübridisatsioon sp3d2 või d2sp3; eriti iseloomulik kui ligandid on neutraalsed
Koordinatsooniarvule 4 vastab üldiselt tetraeedriline kuju; hübridisatsioon on sp3. See on mõnede väiksemate katioonide (Zn2+, Be2+) maksimaalne koordinatsiooniarv kompleksühendites, kuid võib esineda ka teistel katioonidel (eelkõige suhteliselt suuremate ligandide korral). 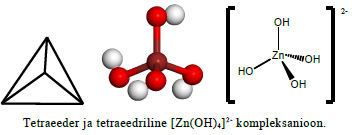
Haruldasem on koordinatsiooniarv 2, mis on iseloomulik I B või II B rühma metallide oksüdatsiooniastmes I katioonide kompleksidele (Ag+, Cu+, Au+, Hg22+) (ehk nendes aatomites on d-orb täis) 
See on nende maksimaalne koordinatsiooniarv kompleksühendites, kuid erandina võib see esineda ka mõnedes teiste katioonide kompleksides. Koordinatsiooniarvu 2 korral paiknevad ligandid lineaarselt, teine teisel pool tuuma.
Suuremad koordinatsiooniarvud: 5 ja 6 perioodi siirdemetallide katioonid saavad enamasti moodustada suurema koordinatsiooniarvuga kompleksühendeid kui 6 (mõnedel f- elementidel esineb isegi komplekse koordarvuga 12)
Erand: 
Koordinatsiooniarv 5-> pentakarbonüülraud
Koordinatsiooniarv 4: NiCl4-> sp3;
Tooge näiteid ühehambalistest ja mitmehambalistest ligandidest. Mis on kelaadid?
Mitmehambalised ligandid saavad anda sidet mitme elektronipaariga, st. Täita mitu koordinatsioonikohta korraga. Mitmehambaliste ligandide puhul tekivad kompleksühendis sageli 5-6 aatomilised kinnised tsüklid. Vastavaid komplekse nimetatakse kelaatideks. Kelaadi tekkeks peavad ligandid olema sobiva suuruse ja kujuga. Kõige levinumad on kahehambalised ligandid, näiteks:C2O4H2 – ehk oksalaatioon (oblikhappe ehk etaandihappe anioon), :NH2-CH2-CH2- H2N: ehk etüleendiamiin jt. Tuntakse ka kolme-, nelja- ja isegi kuuehambalisi ligande. Kuuehambaline ligand on näiteks etüleendiamiintetraetaanhappe anioon (EDTA), mida kasutatakse laialdaselt mitmete katioonide kontsentratsiooni kompleksonomeetrilisel määramisel.
Ühehambalised on kloro, jodo, karbonato, nitro, tsüano jm.
Tooge näiteid mitmetuumalistest kompleksidest. Millised ligandid saavad käituda sildligandidena mitmetuumalistes kompleksides?
Mitmetuumalistes kompleksühendites on tuumad enamasti ühendatud ühe või mitme ligandi ehk silla abil. Vastavatel ligandidel peab olema vähemalt kaks vaba elektronipaari. Tüüpilised sildligandid on OH–, O2– ja Cl–. Mitmetuumalised on mitmed oksokompleksid, näiteks K2[Cr2O7] ehk kaaliumdikromaat on kahetuumaline kompleks: [O3Cr-O-CrO3]2-
Mis on klastrid? Mille poolest nad erinevad teistest mitmetuumalistest kompleksidest?
Klaster on mitmetuumaline kompleks, kus tuumad on omavahel vahetult keemilis(t)e sideme(te)ga ühendatud. Klastrid on eriti iseloomulikud molübdeenile ja volframile. Volfram moodustab näiteks klastri: [W2Cl9]3–. 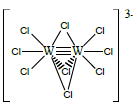
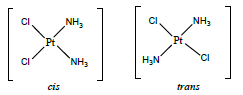
Millised on kompleksühendite isomeeria põhiliigid (selgitused, näited)?
Isomeeria, mis on omane igasugustele ühenditele ja ka kompleksühenditele:
 Geomeetriline ehk cis-trans isomeeria: eri tüüpi ligandide erinev paigutus isomeerides. Võib esineda nii oktaeedriliste kui ka ruudukujuliste komplekside korral, näiteks [PtCl2(NH3)2]. EI esine tetraeedrilistes kompleksides
Geomeetriline ehk cis-trans isomeeria: eri tüüpi ligandide erinev paigutus isomeerides. Võib esineda nii oktaeedriliste kui ka ruudukujuliste komplekside korral, näiteks [PtCl2(NH3)2]. EI esine tetraeedrilistes kompleksides
Cis: samatüüpi ligandid on lähestikku
Trans: sama tüüpi ligandid on vastasasendis
Optiline ehk peegelisomeeria (kiraalsus): esineb keerulisemate komplekside (nt kelaatide) korral. Ligandide vahekaugused on võrdsed, kuid isomeerid on teineteise peegelpildid. [Cr((NH3CH2)2)3]3+ 
Isomeeria liigid, mis on iseloomulikud ainult kompleksühenditele:
Ionisatsiooni-isomeeria: eri tüüpi anioonsete ligandide erinev jaotumine sise-ja välissfääri vahel: [Co(NH3)4Cl2]Br vs [Co(NH3)4ClBr]Cl
Hüdraatne (solvaatne) isomeeria: eelmise erijuht, toimub lahusti erinev jaotuminesise- ja väilssfääri vahel. Avaldub kristallveega komplekside korral (tahkes olekus). See, milline kompleks tekib, sõltub sünteesitingimistest (ligandi ja vee kont suhtest). 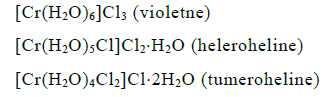
Koordinatsiooniisomeeria: esineb bikompleksides, sellised kui nii anioon kui ka katioon on kompleksioonid: 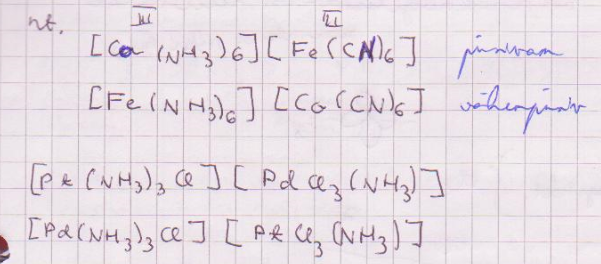
Sideme- ehk soolaisomeeria: esineb ainult teatud liiki ligandide korral, selliste korral, mis saavad anda sidet erinevate aatomitega-> ambidentaatsed ; nitro ja tiotsüano puhul (tiotsüano kui S; tiotsüanato kui N-otsaga)
Millised on kompleksi MA2B2C2 võimalikud geomeetrilised ja optilised (peegel-) isomeerid (selgitage struktuurivalemitega)?
Kuju |
A asend |
B asend |
C asend |
Cis |
cis |
Trans |
|
Trans |
Trans |
Trans |
|
Trans |
Cis |
Cis |
|
Cis |
Trans |
Cis |
|
Cis |
Cis |
Cis |
Kiraalne: 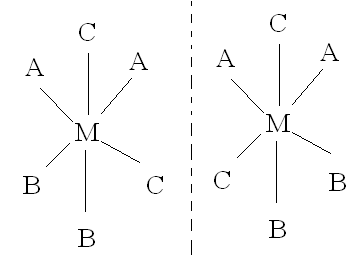
Millised on kompleksi [MCl(NH3)3en)Br võimalikud isomeerid (en – kahehambaline ligand etüleendiamiin)?
2 geomeerilist isomeeri, 1 peegelisomeer ja üks ionisatsiooniisomeer (kus Cl ja Br vahetavad kohad)
Millised tegurid ja kuidas mõjutavad lõhestumisparameetri suurust kompleksühendites?
Lõhestumisparameeter näitab kui suur on energeetiline lõhe soodsate ja mittesoodsate d-orbitaalide vahel (ehk kui palju kulub energiat, et ergastada elektronid soodsamatelt ebasoodsamatele d-orbitaalidele. Kui lõhestumisparameeter on suur, siis ei kehti Hundi reegel) Seda mõjutavad:
kompleksimoodustaja oksüdatsiooniaste – kõrgema oks-astmega kompl moodustaja moodustab ligandidega tugevama sideme => lõhestumisparameeter suureneb.
Ligandi omadused: mida parem elektronpaardoonor on ligand, seda suurem on lõhestumisparameeter.
Millise kujuga on kompleksid [Ni(CN)4]2− ja [Ni(Cl)4]2−, kui esimesel on ? > Ep, teisel ? < Ep (? – lõhestumisparameeter , Ep – elektronide paardumise energia)?
Ruut ja tetraeeder;
Miks oksüdeeruvad koobalt(II) madalaspinnilised kompleksid kergesti vastavateks koobalt(III)-kompleksideks?
Sest koobalt(II) madalaspinnilisel kompleksil jääb 1 paardumata elektron ja 3d orbitaalide hulgas on siis 3 täidetud orbitaali, 1 paardumata elektroniga orbitaal ja 1 tühi orbitaal-> sellise juhul peaks 6 ligandi sidumiseks hübridiseeruma dsp3d orbitaalid; see aga ei ole püsiv, järelikult on vaja sellest paardumata elektronist lahti saada ja moodustada koobalt(III) kompleks. Seega oksüdeeruvad koobalt(II) madalaspinnililised kompleksid kergesti.
Kirjutage kompleksi [Co(NH3)6]Cl3 püsivuskonstandi avaldised astmete kaupa. Kuidas ja miks muutuvad järjestikused püsivuskonstantide väärtused (enamasti)?
Tasakaalukonstanti, mis väljendab kompleksi sisesfääri lagunemist,nimetatakse kompleksühendi ebapüsivuskonstandiks. Mida suurem on ebapüsivuskonstant, seda suuremal määral sisesfäär laguneb (ja vastupidi). Sisesfääri täielikku lagunemist iseloomustab summaarne ebapüsivuskonstantkonstant Kep, mis võrdub kõigi astmete tasakaalukonstantide korrutisega (tetraammiinvask(II)ioon laguneb neljas astmes, seega
Sageli on otstarbekam iseloomustada kompleksühendeid nende tekkereaktsiooni iseloomustavate tasakaalukonstantidega ehk püsivuskonstantidega, mis võrduvad vastavate ebapüsivuskonstantide pöördväärtustega. Summaarne püsivuskonstant Kp võrdub järelikult:
Mida suurem on kompleksühendi püsivuskonstant, seda püsivam ta on (ja vastupidi). Tetraammiinvask(II)ioon on küllaltki püsiv (Kp ≈ 5?1012), mistõttu Cu2+-ioonide sisaldus tetraammiinvask(II)soolade lahustes on üsna väike
Järjestikused püsivuskonstandid lähevad aina suuremaks?
Mis on kaksiksoolad?
Kompleksid milles anioonid on samad, aga katioone on mitu erinevat: 2KCl?CuCl2 →K2[CuCl4]. Spetsiifilised kaksiksoolad: maarjad. Kaks katiooni erinevate laengutega(I ja III), sulfaadid ja 12 vett: AlK(SO4)2*12H2O (tuntud kui maarjas, maarjajää, alumiinuimkaaliumsulfaadi kristallhüdraat)

HAPPED JA ALUSED (43)
1. Kuidas ja miks mõjutavad järgmised tegurid nõrga happe dissotsiatsiooni vesilahuses: a) temperatuuri tõstmine, b) tugeva happe lisamine, c) selle happe soola lisamine, d) lahuse lahjendamine, e) mingi (mitte ühise iooniga) tugeva elektrolüüdi lisamine?
a) temperatuuri tõstmine: mõjutab tasakaalukonstandi väärtust; äkki entroopiaefekti tõttu kasvab dissotsiatsiooni?
b) tugeva happe lisamine: nõrga happe dissots väheneb
c) selle happe soola lisamine: vähendab dissotsiatsiooni?
d) lahuse lahjendamine: Ostwaldi seadus; lahuse lahjendamisel suureneb elektrolüüdi dissotsiatsioonimäär. Lõpmatul lahjendusel saab alfa (dissots konstant) võrdseks ühega.
e) mingi (mitte ühise iooniga) tugeva elektrolüüdi lisamine mõjutab ioonide aktiivusust lahuses; tasakaalukonstanti ei mõjuta, aga mõjutab ioonide aktiivusst lahuses.
2. Millised järgmistest molekulidest või ioonidest käituvad vesilahustes happena, millised alusena protolüütilise teooria järgi; kirjutage nendele vastavate seostatud aluste või hapete valemid: H2O, H3O+, OH−, HF, F−, S2−, HS−, H2S, NH3, NH4+, HNO2, CH4, CN−, CH3COOH, CH3COO−, BCl3, Al3+, AlCl3, Fe3+ jne.
Alused: OH−, H2O, F−; S2−, HS−, NH3; CN−, CH3COO−,
Happed: H3O+, H2O; HF, HS−, H2S, NH4+, HNO2, CH3COOH
Mitte kumbki: CH4; BCl3; Al3+, AlCl3, Fe3+
3. Tooge näide happe ja aluse vahelisest reaktsioonist protolüütilise hapete-aluste teooria järgi (võrrand).
4. Selgitage reaktsiooni NaOH + HCl → NaCl + H2O protolüütilise hapete-aluste teooria seisukohalt.
5. Miks käitub NH3 vee suhtes alusena, H2S ja HF aga happena (igale ainele eraldi põhjendus)?
Sest NH3 on veest nõrgem hape; H2S ja HF aga veest tugevamad happed; ehk divesinisulfiidis on side H-ga nõrgem, sest sidemepikkus on suurem kui vee molekulis=> tugevam hape kui vesi. Ja HF on tugevam hape kui vesi, sest F on O-st elektronegatiivsem ja tõmbab sideme elektronipaari tugevamalt enda poole=> on tugevam hape.Lämmastik on ka vähem elektronegatiivne kui hapnik ja seega sidemed vesinikega on vähem polaarsed kui vees ja seega ei saa ei saa vesikeskkonnas happena toimida.
6. Mis on akvahapped? Millest sõltub nende tugevus happena?
Akvahapped on hüdraatunud metallikatioonid, mille tugevus happena sõltub metallikatiooni polariseerivast toimest-> mida polariseerivam, seda tugevam on ka akvahape.
7. Reastage järgmised akvahapped happelisuse kasvu suunas (põhjendage vastust): [Zn(H2O)6]2+, [Ca(H2O)6]2+, [Fe(H2O)6]2+, [Fe(H2O)6]3+, [Ti(H2O)6]2+.
[Ca(H2O)6]2+, [Ti(H2O)6]2+, [Zn(H2O)6]2+, [Fe(H2O)6]2+, [Fe(H2O)6]3+
Mida polariseerivam on katioon, seda tugevam akvahape. Seega mida väiksem ja mida suurema laenguga on katioon, seda tugevam on akvahape. 4 perioodi d-elementide aatomiraadiused (pm?).
Sc162 |
Ti147 |
V134 |
Cr128 |
Mn127 |
Fe126 |
Co125 |
Ni124 |
Cu128 |
Zn134 |
8. Kirjutage reaktsiooni võrrand, kus akvahape reageerib happena a) H2O suhtes; b) OH− suhtes.
9. Millised välistegurid, kuidas ja miks mõjutavad soola hüdrolüüsi tugevust?
pH
Temperatuur: hüdrolüüs on endotermiline protsess, temperatuuri tõstmisel hüdrolüüs tugevneb.
Soola lahuse kontsentratsiooni suurenedes väheneb vee kontsentratsioon=> seda vähem hüdrolüüsub. Lahuse lahjendamisel hüdrolüüs tugevneb
(Soola enda omadused; mida suurem katiooni laeng ja mida väiksemad möötmed, seda tugevamalt hüdrolüüs toimub)
10. Milline on soola iseloomu mõju hüdrolüüsi tugevusele (näited, põhjendused)?
Katioon: mida suurem laeng ja väiksemad mõõtmed, seda tugevamini hüdrolüüsub; kui aktiivsed metallid; siis kovalentsed sidet ei moodustu ja katiooni mõju veele on elektrostaatiline (tõukab vesinikku, sest ka vesinik +-laenguga). Siirdemetallide korral tekib katiooni ja vee vahele kovalentne side-> siis avaldab katioon polariseerivat toimet. Nõrkade hapete anioonid hüdrolüüsuvad ka.
11. Kirjutage Na3AsO4 ja CrCl3 hüdrolüüsi võrrandid (ioonselt, astmete kaupa). Milline keskkond tekib hüdrolüüsil? Kuidas mõjutab selle soola hüdrolüüsi tugevust: • temperatuuri tõstmine, • lahuse lahjendamine, • happe lisamine, • leelise lisamine?
I aste AsO43- + H2O ↔ HAsO42- + OH-
II aste HAsO42- + H2O ↔ H2AsO4- + OH-
III aste H2AsO4- + H2O ↔ H3AsO4 + OH-
Hüdrolüüsil tekib aluseline keskkond; mida aluselisem keskkond, seda vähem hürdolüüsi toimub (Le Chatelier’ printsiip); lahuse lahjendamine suurendab hüdrolüüsi (lähteaine konts suurendamine); happe lisamine nihuteb tadakaalu hüdrülüüsumise poole; leelise lisamine soodustab pöördreaktsiooni
I aste Cr3+ + H2O ↔ CrOH2+ + H+
II aste CrOH2+ + H2O ↔ Cr(OH)2+ + H+
III aste Cr(OH)2+ + H2O ↔ Cr(OH)3 + H+
12. Millised tegurid mõjutavad oksohapete tugevust (põhjendused, näited)?
happelisus tugevneb tsentraalse elemendi oksüdatsiooniastme kasvamisel (sellega kaasneb ka tsentraalelemendi elektronegatiivsuse kasv);
happelisus tugevneb oksorühmade arvu kasvamisel.Oksorühm on kõrge elektronegatiivsusega ja avaldab tugevat polariseerivat toimet tsentraalaatomile, mis omakorda polariseerib –OH-rühma. ; suuremate tsentraalaatomite korral on eelistatud suurem OH-rühmade arv; väiksemate korral on püsivam suurema okso-rühmade arvuga vorm-
Samuti mõjutavad asendusrühmad (F; Cl jmt)
Tsentraalaatomi raadius: 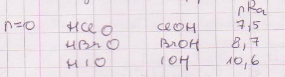
13. Millised tegurid ja kuidas võivad mõjutada oksorühmade arvu happe molekulis?
Tsentraalaatomi suurus-> mida väiksem on aatom, seda tõenäolisemalt tekib kahe OH-rühma asemel 1 okso =O rühm;
14. Reastage järgmised oksohapped happelisuse kasvu järjekorras (põhjendage vastust): HClO, HClO4, HNO2, H4SiO4, H2SO4.
H4SiO4, HClO, HNO2, H2SO4, HClO4; Selles järjekorras kasvab okso-rühmade hulk.
15. Millised on põhilised anorgaaniliste Lewis’i hapete tüübid?
Prooton (kõik protoonse teooria happed)
Metalli katioon (kompleksi teke)
Molekul, milles tsentraalsel aatomil on tühi orbitaal ja reaktsioonil moodustub tsentraalse elemendile elektronoktett, nt BCl3
Molekul või ioon, milles saab tekkida tühi orbitaal (happeline oksiid: CO2, SO3)
Molekul, milles aatomil tekib hüpervalents 
16. Tooge 3 näidet erinevat tüüpi Lewis’i happe ja aluse vahelisest reaktsioonist (hapete-aluste elektronteooria järgi).
 ;
; 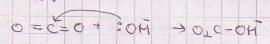 ;
; 
17. Millised järgmistest osakestest saavad käituda happena või alusena Lewis’i teooria järgi? Põhjendage lähtudes osakeste elektronstruktuurist.
H+, H2O, OH−, H3O+, HF, F−, NH3, NH4+, NH2−, N2H4, NH2OH, S2−, HS−, H2S, CH4, CO, CN−, SiCl4, BCl3, H3BO3, Al3+, AlCl3, SbCl5, Fe3+, Zn2+ jne.
Happed: H+; SiCl4, BCl3, H3BO3, , Al3+, AlCl3, SbCl5, Fe3+, Zn2+
Alused: H2O; OH−, HF, F−, NH3, NH2−, N2H4, NH2OH, S2−, HS−, H2S, CO, CN−
Mitte kumbki: H3O+, NH4+, CH4
18. Mis on aprotoonsed happed? Tooge näiteid.
Aprotoonsed happed on happed, millel on tühi orbitaal ja mis saavad käituda elektronipaari aktseptoritena, boortrikloriid ja alumiiniumtrikloriid näiteks.
19. Millel põhineb hapete ning aluste jaotus kõvadeks (jäikadeks) ja pehmeteks? Tooge nende kohta näiteid.
Põhineb Lewisi happe sideme tugevusel halogeniidiga (kui kõige tugevam side F=> kõva hape; kui kõige tugevam side I =>pehme hape)
Tugevamad sidemed moodustuvad sama „kõvadusega“ happe ja aluse vahel. Näiteks kompleksi moodustumisel-> nikli tiotsüanokompleksis seostub tiotsüanaat-ioon oma N-otsaga, sest see on kõvaduselt Ni-le sobivam.
Kõvades hapetes domineerib iooniline side ja HOMO-LUMO erinevus on suur.
Pehmed alused/happed on hästi polariseeritavad. Kõvad alused/happed on vähe polariseeritavad, tugevate polariseerivate omadustega.
20. Miks seostuvad tugevamini kõvad happed-alused omavahel ja pehmed happed-alused omavahel?
Moodustuv side on tugevam, sest nende aatomiorbitaalid on sarnasemad ja seetõttu on moodustavad lihtsamini molekulorbitaalid.
REDOKSPROTSESSID
Millised on seosed: a) redokspotentsiaali E ja reaktsiooni vabaenergia muutuse ΔG vahel; b) redokspotentsiaali ja reaktsiooni tasakaalukonstandi K vahel, c) reaktsiooni vabaenergia muutuse ja tasakaalukonstandi vahel (standardtingimustes)?
a)võrdeline seos(E~ -ΔG); ΔG = -nFE
b)logaritmilne seos( nFE=RTlnK)
c)logaritmiline ΔG=- RTlnK
Mida väljendavad järgmised diagrammid: a) Ellinghami diagramm, b) Latimeri diagramm, c) Frosti diagramm, d) Pourbaix’ diagramm? Milliseid järeldusi on võimalik ainete redoksomaduste kohta teha nende diagrammide alusel?
Latimeri diagramm näitab ühest oa.’st teise oa’sse ülemineku redokspotentsiaali väärtusi.Saab näha, millised ühendid annavad disproportsioneerumisreaktsiooni, mis on tugevaim oksüdeerija, tugevaim redutseerija reas jmt.(Tuleb silmas pidada üleminevate elektronide arvu, kui üritada mingi summarse protsessi standardpot leida!)
 Frosti diagramm iseloomustab kindla elemendi vabaenergia sõltuvust oksüdatsiooni astmest. Sellega saab illustreerida elemendi oksüdatsiooniastmete stabiilsust. Frosti diagramm koostatakse kindla pH juures, niisiis diagrammi juurde on see vajalik juurde märkida. Kahe punkti vaheline tõus näitab reaktsiooni potentsiaali (mida suurem negatiivne tõus pärast punkti, seda tugevam redutseerija on selles punktis; mida suurem positiivne tõus enne mingit punkti, seda tugevam oksüdeerija on see punkt). Samuti saab näha, mis ühendid disproportsioneeruvad hästi.
Frosti diagramm iseloomustab kindla elemendi vabaenergia sõltuvust oksüdatsiooni astmest. Sellega saab illustreerida elemendi oksüdatsiooniastmete stabiilsust. Frosti diagramm koostatakse kindla pH juures, niisiis diagrammi juurde on see vajalik juurde märkida. Kahe punkti vaheline tõus näitab reaktsiooni potentsiaali (mida suurem negatiivne tõus pärast punkti, seda tugevam redutseerija on selles punktis; mida suurem positiivne tõus enne mingit punkti, seda tugevam oksüdeerija on see punkt). Samuti saab näha, mis ühendid disproportsioneeruvad hästi.
Pourbaix’ diagrammil on näidatud potentsiaali sõltuvus pHst, kus graafikul on kujutatud alasid, milles üks või teine vorm on stabiilne. Jooned Pourbaix-diagrammil näitavad tasakaaluolekut ehk sellel joonel on mõlema vormi aktiivsused võrdsed.
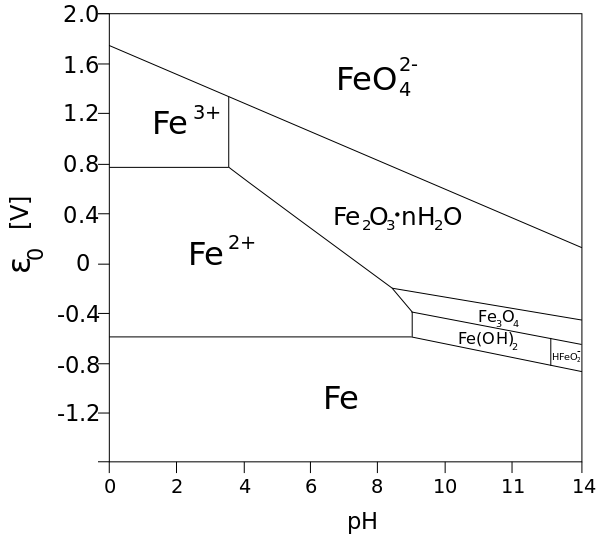 Joonte asukohti mõjutavad ligandid, temperatuur, kontsentratsioon. (natuke faasidiagrammi moodi) Sellelt ei saa välja lugeda midagi reaktsiooni kiiruse või kineetiliste efektide kohta.
Joonte asukohti mõjutavad ligandid, temperatuur, kontsentratsioon. (natuke faasidiagrammi moodi) Sellelt ei saa välja lugeda midagi reaktsiooni kiiruse või kineetiliste efektide kohta.
Ellinghami diagramm näitab lihtainete oksüdeerimise vabaenergia sõltuvust temperatuurist.Seda kasutatakse tihti iseloomustamaks metalli oksiidide ja sulfiidide redutseerimise lihtsust (kui kõrget temperatuuri on vaja, et redutseerida.). Reaktsiooni kineetikat ei võeta arvesse => TD soodsad protsessid ei pruugi tegelikkuses toimida või võivad olla aeglased
Kuidas on redokspotentsiaalide põhjal võimalik otsustada, et a) aine on tugev oksüdeerija või redutseerija, b) ainele on iseloomulik autoredoksreaktsioon?
a) Mida suurem positiivne standardne redokspotentsiaal on redokspaaril, seda tugevam oksdeerija on selles redokspaaris oksüdeeritud vorm. Mida negatiivsem E seda tugevam redutseerija on redutseeritud vorm
b) Ainele on iseloomulik autoredoksreaktsioon kui ainele on iseloomulikud nii oksüdeerivad kui redutseerivad omadused. Latimeri diagrammil paremale jääv suurus on suur (hea oksüdeerija) ja kui vasakule jääv suurus on väike (hea redutseerija).
Millistele alltoodud ainetest on iseloomulik käituda: a) oksüdeerijana, b) redutseerijana, c) nii oksüdeerijana kui ka redutseerijana (olenevalt reaktsioonipartnerist)? Milline saadus seejuures tekib (enamasti)? Millistel juhtudel on reaktsiooni toimumiseks vajalik kuumutamine?
a) H2, NaH, H2O, O2, H2O2, Cl2, HCl, KClO, I2, HI,
b) S, H2S, H2SO3, konts. H2SO4, Na2S2O8,
c) NH3, Li3N, KNO2, KNO3, P4, PH3, KPO2H2, H2PO3H, P4O10,
d) SnCl2, Pb, PbSO4, PbO2, KBiO3, MnCl2, Mn(OH)2, MnO2,
e) Cr(OH)2, CrCl3, K3[Cr(OH)]6, K2CrO4, K2Cr2O7, CrO3,
f) Fe, FeCl2, FeCl3, Ni(OH)2, NiOOH, CuCl, CuCl2, Ag, AgNO3 jne.
Vastuseid vaatasin üldiselt Atkins’ Inorganic Chemistry Latimeri diagrammidelt; kohati lähtusin nendest, kohati sellest, mis ühendid üldse võimalikud on.
a) O: O2, H2O2, Cl2, KClO, I2
R: H2; NaH
mõlemat: H2O, HCl, HI,
b) O: konts. H2SO4
R: H2S; Na2S2O8,
mõlemat: S, H2SO3,
c) O: KNO3
R: Li3N, NH3, PH3; KPO2H2; P4O10
Mõlemat: KNO2, P4; H2PO3H,
D) O: PbO2; KBiO3,MnO2 (oksüdeerija happelises lahuses)
R: Pb, Mn(OH)2 (redutseerija aluselises lahuses)
mõlemat: SnCl2; PbSO4; MnCl2;
e) O: K2CrO4, , K2Cr2O7; CrO3
R: K3[Cr(OH)]6, CrCl3 (aluselises lahuses käitub kroom(III) redutseerijana)
mõlemat:
f) O: (FeCl3,); AgNO3; CuCl (Cu(II) on stabiilsem), NiOOH (käitub oks-na sest Ni(II) on stabiilsem)
R: Fe, FeCl2, Ag, CuCl2 (saab olla redutseerija, sest Cu(I) on ka stabiilne); Ni(OH)2 (saab käituda, kuna Ni (III) ka eksisteerib),
mõlemat:
Gaasilise HCl saamiseks kasutatakse tahke NaCl ja konts. H2SO4 vahelist reaktsiooni (kuumutamisel). Miks pole HBr ja HI võimalik saada analoogilisel viisil (vastavalt NaBr ja NaI reageerimisel konts. H2SO4-ga)?
HBr ja HI reageerivad edasi k. väävelhappega ning tekivad vastavalt broom ja jood. Ehk teisisõnu-> broomi ja joodi anioonid on tugevamad redutseerijad kui Cl-ioon.
Kuidas ja miks sõltub KClO3 tugevus oksüdeerijana lahuse pH väärtusest?
Oksohapete anioonide tugevus oksüdeerijana kasvab pH alanedes (ehk happelistes lahustes on need tugevamad oksüdeerijad). See on nii, sest reaksioonivõrrandit vaadates on näha, et aniooni redutseerumisel on lähteainetes palju H+ ioone (sest moodustub vesi)
Kui pH on happelisem, siis vesinikioonid seovad paremini hapnikuaatomeid ja seega on ühend tugevam oksüdeerija.
Tahke KMnO4 ja konts. HCl vahelist reaktsiooni kasutatakse laboris Cl2 saamiseks. Samas on ka vastupidine võimalus – KMnO4 võib saada Cl2 abil (K2MnO4 oksüdeerimisel). Kuidas seda näilist vastuolu seletada?
Happelises keskkonnas on KMNO4 väga tugev oksüdeerija, molekulaarsest kloorist tugevam; aga aluselises keskkonnas on Cl2 tugevam oksüdeerija ja selle abil saab permanganaati sünteesida küll.
Millises keskkonnas (happelises, neutraalses või aluselises) on kergem Cr(III) ühendeid oksüdeerida Cr(VI) ühenditeks? Miks?
Aluselises; kuna siis E0 CrO42-/Cr(OH)4- = -0,13 vs happelises sarnase ülemineku E0 on 1,38 => aluselises keskkonnas on kroom(III) tugevam redutseerija ja seega saab aluselises keskkonnas lihtsamini Cr(VI) ühendeid.
Kumb oksüdeerub kergemini, kas Fe(OH)2 või FeSO4? Miks?
Aluselises keskkonnas on stabiilsemad kõrgemad oksüdatsiooniastmed; seega oksüdeerub kergemini Fe(OH)2
Kirjutage järgmiste redokspaaride osavõrrandid (poolreaktsioonide võrrandid) ja redokspotentsiaali avaldised:
a) happelises keskkonnas: NO3 −/HNO2, ClO3 −/Cl−, Cr2O7 2−/2Cr3+;
b) neutraalses või aluselises keskkonnas: NO3 −/NO2 −, ClO3 −/Cl−; CrO4 2−/Cr(OH)6 3−.
a) happelises keskkonnas:
3H+ + NO3 - + 2e- -> HNO2 + H2O
6H+ + ClO3 - + 6e- -> Cl- + 3H2O
14H+ + Cr2O7 2− + 6e- -> 2Cr3+ + 7H2O
b) neutraalses/aluselises keskkonnas:
H2O + NO3 - + 2e- -> NO2 - + 2OH-
3H2O + ClO3 - + 6e- -> Cl- + 6OH-
4H2O + CrO4 2- + 3e- -> Cr(OH)6 3- + 2OH-
Kirjutage reaktsioonide võrrandid, milles:
H2 käitub oksüdeerijana,
H2 käitub redutseerijana,
H2O käitub oksüdeerijana,
H2O käitub redutseerijana,
H2O2 käitub oksüdeerijana (vesilahuses),
H2O2 käitub redutseerijana (vesilahuses),
Cl2 käitub oksüdeerijana (vesilahuses),
Cl−-ioonid käituvad redutseerijana (vesilahuses),
I−-ioonid käituvad redutseerijana (vesilahuses),
KClO3 käitub oksüdeerijana (happelises keskkonnas),
S2−-ioonid käituvad redutseerijana (vesilahuses),
SO2 käitub redutseerijana (vesilahuses),
SO2 käitub oksüdeerijana (vesilahuses),
konts. H2SO4 käitub oksüdeerijana,
HNO3 käitub oksüdeerijana,
KNO2 käitub redutseerijana (vesilahuses),
KNO2 käitub oksüdeerijana (vesilahuses),
KMnO4 käitub oksüdeerijana (happelises lahuses),
KMnO4 käitub oksüdeerijana (neutraalses lahuses),
K2Cr2O7 käitub oksüdeerijana (happelises lahuses),
K2Cr2O7 käitub oksüdeerijana (neutraalses lahuses),
K2CrO4 käitub oksüdeerijana (aluselises lahuses),
Fe3+-katioonid (lahuses) käituvad oksüdeerijana (happelises keskkonnas),
Fe2+-katioonid (lahuses) käituvad redutseerijana (happelises keskkonnas),
Cu2+-katioonid (lahuses) käituvad oksüdeerijana.
VI. LIHTAINED
Kuidas muutub lihtainete struktuur (tahkes olekus) järgmises ainete reas (põhjendage vastust): Ar → Cl2 → S → P → Si?
Argoonil on argooni aatomid ja nende vahel van der Waalsi jõud, Cl2 puhul on Cl2 molekulid ja nende vahel van der Waalsi jõud molekulaarvõre, mittepolaarne kovalente, gaasiline, kuna väike, S puhul aatomvõre., hästi tugev 1D aatomvõre ahelate vahel van der Waals; P aatomiliskihiline võre 2D aatomvõre kihtide vahel van der Waals, kaootiliselt, hästi tugev, ruumiline. Si puhul aatomvõre 3D,igat pidi keemiline side. Kovalentne mittepolaarne. Põhjuseks on siis kokkuvõtlikult paardumata elektronide arvu suurenemine selles reas ja koos paardumata elektronide arvuga kasvab võimalike sidemete arv
Kuidas muutub (reeglina) metalliliste elementide sulamistemperatuur perioodilisustabeli A-rühmades ja B-rühmades ülevalt alla ja perioodides vasakult paremale? Miks?
B- rühmades ülalt alla st kasvab, kuna kovalentse sideme osakaal suureneb;. A rühmades ülalt alla st kahaneb, sest metalliline side nõrgeneb aatomiraadiuste kasvamise tõttu. Vasakult paremale A rühmas suureneb, kuna kovalentse sideme osakaal suureneb, aatomid on väiksemad., tõmbab elektrone rohkem ligi tuum. B metallidel keskele suureneb, kuna paardumata d-elektronide arv keskele kasvab ja seega on rohkem kovalentseid sidemeid andvaid elektrone.
Li454 K |
Na371 K |
K337 K |
Rb312 K |
Cs301 K |
Miks on süsiniku allotroobid väga kõrge sulamistemperatuuriga tahked ained, talle perioodilisustabeli 2. perioodis järgnevate mittemetalliliste elementide lihtained on aga tavatingimustes gaasilises olekus?
Süsinikul on ergastatud olekus võimalik moodustada kuni 4 sidet. Lisaks sellele on C-C sidemed väga tugevad (just ühekordsed sigma-sidemed)(O-O ja N-N ühekordsed sidemed on nõrgad, sest O ja N on väga väikesed ja laengutihedus on väga suur)
Miks on lämmastik ja hapnik tavatingimustes gaasid, fosfor ja väävel aga tahked ained?
Lämmastikul ja hapnikul madalam molaarmass, väikesed, avaldavad tugevaid tõukejõude (sest laeng kokku surutud väga väiksesse ruumalasse) ei ole otstarbekas moodustada suuremaid üksusi, fosfor ja väävel saavad sidemete moodustamiseks kasutada ka d-orbitaale.
Kuidas muutub (reeglina) mittemetallide sulamistemperatuur rühmades ülevalt alla ja perioodides vasakult paremale? Miks?
Ülevalt alla sulamistemperatuur kasvab, ning vasakult paremale kahaneb kuna van der waalsi jõud kahanevad (molekulid muutuvad reeglina aina väiksemaks). Aatomid muutuvad väiksemaks, sidemed nõrgemaks vasakult paremale (va väärisgaasid, mille aatomid on suhteliselt suured).
Millisel järgmistest ainetest on kõige kõrgem ja millisel kõige madalam sulamistemperatuur? Miks?
S8, P(punane), Si, C (teemant);
Na, Cs, Ba, Ca, Be, Li;
Cu, Au, Mo, Hg, Sc, Cr, W, Zn.
a) kõrgeim: C(teemant), sest tugevad kovalentsed sidemed terves faasis; madalaim S8 sest suhteliselt väikesed molekulid, mille vahel vdW jõud
b) Cs-madalaim, sest suurim raadius ja vähem metallilist sidet koos hoidvaid valentselektrone; Be- kõrgeim, sest väikseim raadius ja rohkem valentselektrone
c) Hg- madalaim, sest d-orbitaal on täitunud ja seega kovalentseks sidemeks seega ainult s-elektronid, mis omakorda on rohkem tuuma lähedal ? W- kõrgeim palju valentselektrone;
Võrrelge s-, p- ja d-metallide tüüpilisi füüsikalisi omadusi ja põhjendage erinevusi.
s-metallid on pehmed, juhivad hästi elektrit, d-metallid on üldiselt väga kõrgete sulamistemperatuuridega, kõvad, tugevad, juhivad hästi elektrit. P-metallid on hapramad ja kristalsemad, juhivad halvemini elektrit
Kuidas ja miks muutub d-elementide oksüdatsiooniastmete püsivus rühmas (ülevalt alla) ja piki dekaadi (vasakult paremale)?
Rühmas ülevalt alla muutuvad püsivamaks suuremad oks-astmed (Kuna aatomid suuremad ja annavad elektrone paremini ära, samuti tahavad moodustada rohkem sidemeid) Vasakult paremale on keskel kõige suurem , siis jälle väheneb. elektronstruktuuri pärast.
Miks on titaani püsivaim oksüdatsiooniaste ühendites IV, temast perioodilisustabelis vasakulpool asuval skandiumil ja paremalpool asuval raual raual aga III?
Miks piki d-elementide dekaadi maksimaalses (rühma numbriga võrdses) oksüd. astmes ühendite püsivus väheneb ja oksüdeerivad omadused tugevnevad?
Tuumalaeng kasvab, efektiivne tuumalaeng kasvab. Oksüdeerivad omadused tugevnevad kuna aatom hoiab elektrone tugevamini kinni suurema tuumalaengu tõttu
Miks on molübdeeni ja volframi püsivaim oksüdatsiooniaste ühendites VI, sama rühma elemendil kroomil aga III?
Sest rühmas alla muutuvad kõrgemad oksüdatsiooniastmed stabiilsemaks; tänu suuremale oksüdatsiooniastmele saavad W ja Mo anda rohkem keemilisi sidemeid, mis ka stabiliseerivad seda kõrget oks-astet.
Kirjutage lihtainetele iseloomulike reaktsioonide võrrandid (valides sobiva lihtaine, millega vastav reaktsioon toimub):
a) Metallid
reageerimine hapniku jt. mittemetallidega;
2Mg + O2 => MgO
Fe + C2
reageerimine tavaliste hapete lahustega;
Fe + lahj. H2SO4 => FeSO4 + H2
reageerimine konts. väävelhappega;
Fe + 2 konts. H2SO4 => FeSO4 + 2H2O + SO2
reageerimine lämmastikhappega (erineva kontsentratsiooniga);
konts => eraldub NO2; lahj => NO
reageerimine veega või veeauruga (kuumutamisel);
Aktiivsed=> hüdroksiid
reageerimine leelise lahusega;
amfoteersed: Al; Zn, Be
b) Mittemetallid
reageerimine hapniku jt. mittemetallidega;
reageerimine metallidega;
reageerimine veega;
reageerimine leelise lahusega;
reageerimine konts. lämmastik- või väävelhappega (kuumutamisel).
BINAARSED ÜHENDID
1. Millised järgmistest binaarsetest ühenditest ja miks on a) happelised, b) aluselised, amfoteersed: CO2, SO3, Fe2O3, CaO, SiO2, CrO, CuO, CO, NO2, SnO2, Cr2O3, NO, CrO3, NH3, LiH, CH4, H2S, HF, KCl, NaF, CCl4, PCl5, K2S, Al2S3, CS2 jne?
a) happelised: CO2, SO3, CrO3, NO2, H2S, PCl5, SiO2; H2S; HF
b) aluselised: CaO, LiH (Lewis; aluseline hüdriid), K2S, CS2, NH3, CO(Lewis), NO(Lewis), KCl, NaF, CCl4; CrO; CuO; KCl (aluseline kloriid), NaF()
c) amfoteersed: Fe2O3, Al2S3, SnO2; Cr2O3
Millised eelmises küsimuses esitatud binaarsetest ühenditest reageerivad veega? Kirjutage vastavate reaktsioonide võrrandid. Millised nendest reaktsioonidest kulgevad praktiliselt lõpuni?
Veega reageerivad: CO2, SO3, CrO3, NO2, H2S, PCl5, LiH; CaO; K2S, NH3, NaF, Al2S3, CS2
Võrrelge ja põhjendage CrO, Cr2O3 ja CrO3 happelis-aluseliste omaduste erinevust? Millistes keemilistes reaktsioonides see erinevus avaldub?
CrO on praktiliselt ainult aluselised omadused; CrO ja Cr(OH)2 reageerivad ainult hapetega: CrO + 2H3O+ + 3 H2O => [Cr(OH2)6)2+
Cr2O3 on raskesti sulav ja keemiliselt üsna inertne; selle amfoteerne loomus ilmneb kokkusulatamisel vastavate ühenditega; näiteks kokkusulatamisel kaaliumtiosulfaadiga (käitub alusena):
Cr2O3 + 3K2S2O7 => Cr2(SO4)3 + 3K2SO4
Cr2O3 kokkusulatamisel leeliste ja vastavate oksiididega tekivad oksokromaadid(III) (käitub happena)
Cr2O3 + 2KOH => 2KCrO2 + H2O
CrO3 on kõige happelisem, sest selles on Cr oksüdatsiooniaste 6 ja seega elektronegatiivus väga suur; veega reageerides moodustub kroomhape
CrO3 + H2O => H2CrO4
Kirjutage binaarsetele ühenditele iseloomulike reaktsioonide võrrandid:
a) Oksiidid
erinevat tüüpi oksiidide reageerimine veega, hapete või leeliste lahustega;
aluselise oksiidi reageerimine happelise oksiidiga.
b) Halogeniidid
erinevat tüüpi halogeniidide reageerimine veega, hapete või leeliste lahustega;
aluselise halogeniidi reageerimine happelise halogeniidiga;
c) Sulfiidid
erinevat tüüpi sulfiidide reageerimine veega, hapete või leeliste lahustega;
aluselise sulfiidi reageerimine happelise sulfiidiga;
d) Hüdriidid
erinevat tüüpi hüdriidide reageerimine veega, hapete või leeliste lahustega;
aluselise hüdriidi reageerimine happelise hüdriidiga;
amfoteerse hüdriidi reageerimine aluselise või happelise hüdriidiga;
hüdriidide reageerimine hapnikuga;
hüdriidide reageerimine happelise binaarse vesinikühendiga.
Kirjutage järgmiste ainete laboratoorsete saamisreaktsioonide võrrandid:
mittemetallid (H2, O2, Cl2, Br2, I2, S, N2 jt.);
metallid (Cu, Ag, Fe, Ni jt.);
binaarsed ühendid (HCl, HBr, HI, H2S, SO2, NH3, NO, NO2, PH3, CO2, C2H2, SiH4 jt.);
nõrgad, vees vähelahustuvad alused ja happed ( Cu(OH)2, Fe(OH)2, Fe(OH)3, H2SiO3 jt.).
a) Mittemetallid
H2 : 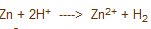
O2: 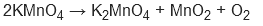
Cl2 : 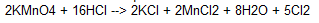
Br2 ja I2: 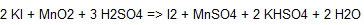
S-> leidub lihtainena raud(II)kloriid + naatriumsulfiid -> raudsulfiid, naatriumkloriid ja väävel; vääveldioksiid + divesiniksulfiid
N2 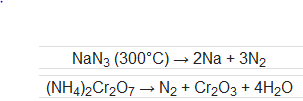
b) metallid
Cu
Ag
Fe
Ni