Ammoniaaklahused
Autor:
Laura LällLisamise aeg:
2015-02-01 13:27:31Vaatamiste arv:
12423Tagasiside:
0 0Tartu Ülikool
Loodus – ja tehnoloogiateaduskond
Keemia Instituut
Ammoniaaklahused ja nende omadused
Laura Läll
Tartu 2014
Sisukord Sissejuhatus 3 Ammoniaagi iseloomustus 3 Ammoniaak kui lahusti, ainete lahustuvus ammoniaagis 5 Ammonohapped ja ammonoalused, nendele iseloomulikud reaktsioonid, ammonolüüs 7 Leelismetallide ammoniaaklahuste struktuur ja omadused 8 Kokkuvõte 9 Kasutatud kirjandus 10 Lisa 1. Küsimused 11
Sissejuhatus
Mis on ammoniaak? Esimesena meenub ehk nuuskpiiritus oma terava iseloomuliku lõhnaga. Kuigi nuuskpiirituse näol on tegu ammoniaagi 5%-lise vesilahusega, siis iseloomustab ka tavatingimustes värvusetu gaasina esinevat ammoniaaki justnimelt väga omapärane lõhn.
Vedelas olekus võib ammoniaaki pidada küllaltki veesarnaseks solvendiks, kuigi esineb ka üksjagu erinevusi, näiteks võib selles lahustada tänu ammoniaagi tugevale ioniseerivale võimele leelismetalle. Lisaks võib neid samu lahuseid kasutada tugevate redutseerivate reagentidena orgaanilises sünteesis.
Elusorganismideski on ammoniaagil tähtis roll – see on lämmastiku allikaks taimedele, loomades aga aitab muuhulgas hoida hape-alus tasakaalu. Tööstuses on tegu ühe ulatuslikumalt toodetud anorgaanilise kemikaaliga, mida peamiselt kasutatakse väetistes, lõhkeainetes ja polümeerides, kuid ka ravimite sünteesil ja puhastusvahendites.
Niisiis võib öelda, et ühel või teisel moel puutub ammoniaagiga kokku pea iga inimene. Antud referaadis antaksegi lühiülevaade ammoniaagist kui molekulist, täpsemalt kirjeldatakse aga ammoniaaki lahustina, ammonohappeid ja –aluseid.
Ammoniaagi iseloomustus
Tavatingimustes on ammoniaak (NH3) värvuseta, terava iseloomuliku lõhnaga gaas, mis lahustub hästi vees, alkoholis ja benseenis. Ammoniaagi sulamistemperatuuriks on -77,75 ?C ja keemistemperatuuriks -33,35 ?C. Seejuures on eeltoodud temperatuurid anomaalselt kõrged võrreldes teiste V rühma binaarsete vesinikühenditega. Selline omadus on tingitud eelkõige vesinik(I) ühendite molekulide vahel võimalikust vesiniksidemest, mis on eriti tugev just F – H, O – H ja N – H sidemeid sisaldavate molekulide vahel (Ahmetov 1974; Karik et al. 1981).
NH3 on trigonaalse püramiidi kujuline (d(NH3) = 1,015 Å, nurk HNH = 107o. Kuna lämmastiku aatomil on sp3-hübridisatsioon, siis on selle mitte-siduv kaheelektroniline pilv ruumis selgelt orienteeritud (Joonis 1). Sel põhjusel on NH3 molekul suure polaarsusega (µ = 1,46 D) elektronipaari doonor (Ahmetov 1974).
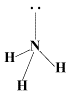
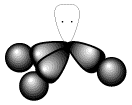
Joonis 1. Lämmastikumolekuli struktuur (www.worldofchemicals.com).
Vesiniksideme põhjustajaks ammoniaagi molekulide vahel on peaasjalikult jagamata elektronipaar lämmastikul ja H – N-sideme polaarsus. Seetõttu veeldub NH3 kergesti ning omab kõrget aurustumissoojust. See omadus võimaldab seda kasutada ka külmutusmasinates (Ahmetov 1974).
NH3 üks saamisviis on selle tootmine lihtainetest järgneva reaktsiooniga:
Seejuures on tarvilik kõrgrõhukeskkond (107 – 108 Pa) ja temperatuur 500 ?C, lisaks raudkatalüsaator. Lähtudes Le Chatelier’ printsiibist, soodustab NH3 teket rõhu tõstmine ja temperatuuri alandamine. Madalal temperatuuril aga on reaktsiooni kiirus küllaltki väike, mistõttu rakendatakse sünteesiprotsessil optimaalse temperatuurina 500 ?C (Karik et al. 1981).
Kuna ammoniaak on hea reaktsioonivõimega ühend, siis on talle iseloomulikud järgnevad reaktsioonid (Karik et al. 1981):
Ühinesmisreaktsioonid – lämmastiku aatom loovutab doonorina sideme tekkeks vaba elektronipaari. Ühinemisel tekkivad ammooniumühendid dissotsieeruvad vesilahuses, seejuures on üheks iooniks ammooniumioon (NH4 + ). Mõned näited:
Kompleksioonide teke on võimalik ka NH3 (või tema vesilahuse) reageerimisel metalliioonidega (Ag + , Cu2+ jt.) ning tekkivaid ühendeid nimetatakse ammoniakaatideks. Näiteks:
Oksüdatsioonireaktsioonid: NH3 oksüdeerub hapnikus vabaks lämmastikuks (NH3-l on redutseerivad omadused). Kui katalüsaatorina oleksid juures Pt-metallid, siis tekiks NO. Näiteks:
Asendusreaktsioonid (asendatakse H-aatomeid). Vesinike asendamisel metallidega tekivad ammoniaagist erinevad nitriidid. Näiteks:
Ammoniaak kui lahusti, ainete lahustuvus ammoniaagis
Vedel ammoniaak on amfiprotoonne protofiilne lahusti, mida esimest korda iseloomustati lahustina juba aastal 1864 (Reichardt 2003). Lähtuvalt selle omadustest peetakse ammoniaaki tihtipeale küllaltki veesarnaseks solvendiks. Kui vedelat ammoniaaki lühidalt iseloomustada, siis omab see keskmise väärtusega dielektrilist konstanti (ε = 22,7 (-50 ?C), ε(H2O) = 81,7 (18 ?C)), kõrget dipoolmomenti (µ = 1,47 D, µ(H2O) = 1,85 D), võimet moodustada vesiniksidet ja kõrget aluselisust. Võrreldes veega omab ammoniaak madalamat keemistäppi (Tabel 1), mis viitab vesiniksidemete väiksemale osatähtsusele ammoniaagis. Seda kinnitab ka NH3 madalam aurustumisentalpia (ΔH(NH3) = 23,3 kJ . mol-1, ΔH(H2O) = 40,7 kJ . mol-1). Sarnaselt veega toimub ka ammoniaagis autoprotolüüs, kuid lähtudes vastavates konstantidest (Tabel 1), võib öelda, et vees toimub protsess oluliselt ulatuslikumalt. Vedela ammoniaagi näol on tegu hügroskoopse ja CO2-ga reageeriva ainega, mistõttu on tarvilik selle atmosfäärist eraldamine (Housecroft ja Sharpe 2005).
Tabel 1. Valitud füüsikalisi omadusi vee ja ammoniaagi kohta (Housecroft ja Sharpe 2005).
| Omadus / ühikud |
NH3 |
H2O |
| Sulamistemperatuur / K |
159,3 |
273,0 |
| Keemistäpp / K |
239,6 |
373,0 |
| Vedeliku tihedus / g . cm-3 |
0,77 |
1,00 |
| Dipoolmoment / D |
1,47 |
1,85 |
| Dieleketriline konstant |
25 (sulamistemperatuuril) |
78,7 (298 K) |
| Autoprotolüüsikonstant |
5,1 10-27 |
1,0 10-14 |
Hoolimata ammoniaagi madalamast dielektrilisest konstandist, loetakse seda siiski küllaltki heaks lahustiks anorgaanilistele ühenditele. Seejuures on ioonsete ühendite lahustumisel lisaks eelpool toodud füüsikalistele ja keemilistele parameetritele olulisel kohal ka lahustatava ühendi võreenergia – kui solvendi ja soluudi vahelised interaktsioonid ei ole stabiliseerivamad soluudi enda molekulidevahelistest vastasmõjudest, siis ei ole aine lahustumine eelistatud protsess. Lisaks võreenergiale mängib lahustumisel rolli ka iooni polariseeritavus, näiteks kasvab halogeniidide lahustumine järgnevas reas: F- < Cl- < Br- < I-. Näiteks võiks tuua AgI, mis on vees halvasti lahustuv, lahustub NH3 lahuses aga väga hästi (206,8 g AgI/100 g NH3-s). Hästilahustuvatest ühenditest võiks eraldi välja tuua ammooniumsoolad (peetakse kõige paremini ammoniaagis lahustuvateks anorgaanilisteks ühenditeks), nitraadid, tsüaniidid, tiotsüaniidid, iodiidid. Suuremat osa sooladest, millel on kõrge hapnikusisaldusega ja laenguga anioon, peetakse aga ammoniaagis halvasti lahustuvaks, sh SO4 2-, PO4 3-, CO3 2-, CrO4 2-. Reeglina lahustuvad ammoniaagis paremini orgaanilised ühendid, millest tulenevalt kasutatakse ammoniaaki lahustina ulatuslikumalt just orgaanilises keemias. Seejuures soodustavad orgaaniliste ühendite lahustumist ammoniaagis polaarsete funktsionaalrühmade olemasolu ning võime olla vesiniksideme doonor ja/või aktseptor, nt lahustuvad hästi aldehüüdid, ketoonid, karboksüülhapped, alkoholid, eetrid jne. (Lagowski 2007; Housecroft ja Sharpe 2005; Atkins et al. 2010; Huheey 1975).
Mitte-vesikeskkonnalised solvendid, mis on head prootoni aktseptorid – näiteks vedel ammoniaak – nö sunnivad happeid ioniseeruma, mistõttu võib aluselises keskkonnas kõiki happeid tugevaks pidada. Niisiis, kuna vedel NH3 on solvendina veest oluliselt aluselisem, siis käituvad paljud vesikeskkonnas nõrgad happed ammoniaagis lahustununa tugevamate hapetena. Seda nähtust kutsutakse nivelleerivaks efektiks. Näiteks on äädikhape ammoniaagis täielikult ioniseerunud vormis (Housecroft ja Sharpe 2005; Atkins et al. 2010):
Kui võrrelda vedela ammoniaagi ja vee elektrijuhtivust, siis on vesi oluliselt parem juht. Seda just prootoni kõrge liikuvuse tõttu vees, mida seletatakse Grotthussi mehhanismiga. Nimetatud mehhanismi järg toimub H+ ülekanne eelnevalt sobivalt orienteeritud veemolekulile prootoni tunnelleerumise tulemusena (Joonis 2). Seega koosneb protsess kahest etapist: 1) vee molekulide reorganisatsioon, 2) H+ tunnelleerumine (kvantmehhaaniline protsess) (konspekt ainest “Füüsikaline keemia II”).
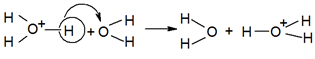
Joonis 2. Grotthussi mehhanismi illustratiivne kirjeldus (konspekt ainest “Füüsikaline keemia II”).
Ammonohapped ja ammonoalused, nendele iseloomulikud reaktsioonid, ammonolüüs
NH4 + ühendid käituvad vedelas ammoniaagis hapetena (nagu OH3 + ühendid vees) ning neid nimetatakse ammonohapeteks. Dihüdronitriidradikaali NH2 - derivaadid käituvad aga alustena just nagu OH- vees. Viimaseid nimetatakse ammonoalusteks. Näiteks käituvad NH4Cl ja NH4NO3 vedelas ammoniaagis tugevate hapetena, Ba(NH2)2 ja KNH2 aga alustena (Ahmetov 1974).
Ammonohapete ja ammonoaluste vahel toimub neutraliseerimisreaktsioon:
Ammonohapetes lahustuvad aluselised ja amfoteersed nitriidid, dihüdronitriidid ja hüdronitriidid, mis ei lahustu vedelas ammoniaagis:
Ammonoleelistes lahustuvad happelised ja amfoteersed nitriidid, dihüdronitriidid ja hüdronitriidid, mis ei lahustu vedelas ammoniaagis:
Lihtained reageerivad vedela ammoniaagi, ammonoaluste ja ammonohapetega:
Vedelas ammoniaagis lahustunud ainetega leiab aset ammonolüüs, mis sarnaselt hüdrolüüsile kujutab endast vahetuslikku ammoniaagi lagunemisreaktsiooni:
Kuna nii hüdrolüüs kui ka ammonolüüs sõltuvad autoionisatsiooni ulatusest, siis vaadates mõlema ühendi vastavaid konstante (Tabel 1), võib järeldada, et hüdrolüüsiprotsessi toimub vees rohkem, kui ammonolüüsumist ammoniaagis (Ahmetov 1974).
Leelismetallide ammoniaaklahuste struktuur ja omadused
Vedelas ammoniaagis lahustuvad kõrge negatiivse reduktsioonipotentsiaaliga metallid. Teisisõnu need metallid, millel on madal ionisatsioonienergia ning kõrge solvatatsioonienergia. Kui põgusalt võrrelda leelis-ja leelismuldmetallide lahustuvust vedelas ammoniaagis, siis solvateeruvad viimased oluliselt halvemini (Douglas et al. 1993).
Eriti hästi lahustuvadki vedelas ammoniaagis just leelismetallid andes pronksja (kontsentreeritud lahus, c > 3 M) või sinise (lahja lahus, c < 3 M) värvusega lahuse. Näiteks võib lahustada 100 g vedelas ammoniaagis temperatuuril – 50 ?C 336 g tseesiumit. Seejuures on metalle võimalik nö taastada ammoniaagi aurustamisel (Douglas et al. 1993; Atkins et al. 2010).
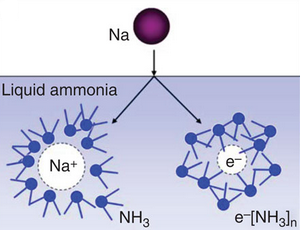
Joonis 3. Naatriumi lahustumisel vedelas ammoniaagis tekivad ammoniaagimolekulide poolt solvateeritud katioonid ja elektronid. Seejuures on NH3 molekulid katioonide ja elektronide puhul erinevalt orienteeritud (www.nature.com).
Lahjades lahustes metalli aatomid ioniseeruvad andes NH3 molekulide poolt solvateeritud metallikatioonid ja elektronid (analoogiana võib solvateeritud elektrone ka vees esineda, kuid see nähtus on vees oluliselt ebastabiilsem ning seetõttu vähepüsiv) (Joonis 3):
Need elektronid täidavad u 3,3 Å suuruse diameetriga tühimikke, mis tekivad vedelikus solvaatkattega ümbritsetud katioonide vahele. Sellise konseptsiooniga leelismetallide lahustest vedelas ammoniaagis võiks seletada ka nende märgatavalt madalamat tihedust ja seega ka ruumala kasvu võrreldes vedela ammoniaagi endaga. Niisuguste lahjade lahuste ebatavaliselt kõrge juhtivus on põhjustatud just nende solvateeritud elektronide kõrgest liikuvusest. Kõrgematel kontsentratsioonidel hakkavab toimuma solvateeritud elektronide ja katioonide paardumine (kusjuures võivad tekkida nii ioonipaarid kui ka –nelikud):
Lahuse kontsentreeritumaks muutumisel esialgu elektrijuhtivus langeb, kuid pärast miinimumini jõudmist hakkab kontsentratsiooni kasvades järjest tõusma, lähendes lõpuks lahustunud metalli enda juhtivusele (King 2005; Douglas et al. 1993).
Sinakad lahused säilivad madalatel temperatuuridel pikalt, muundudes redoksreaktsiooni tulemusena siiski aeglaselt vesinikuks ja nt naatriumamiidiks (NaNH2) (Atkins et al. 2010).
Kokkuvõte
Ammoniaak kui lahusti on küllaltki kõrge dipoolmomendi, dielektrilise läbitavuse ja aluselisusega solvent, milles toimuvad sarnaselt veega nii autoprotolüüs kui ka ammonolüüs. Ammoniaaki on võimalik kasutada nii mõnegi ioonse ühendi lahustamiseks, kuigi eelisseisundis on siin tänu oma veel kõrgemale polaarsusele vesi. See-eest on nimekiri ammoniaagis lahustuvatest orgaanilistest ühenditest võrreldes veega pikem, mistõttu on orgaanilise sünteesi seisukohalt tegu populaarsema solvendiga.
Oma eripalgelisuses võib ammoniaak käituda nii aluse kui happena, mida nimetatakse vastavalt ammonoalusteks või ammonohapeteks. Ka siin on analoogia vesilahustega olemas – näiteks rakendub siingi reakstiooniskeem hape + alus = sool + vesi, kuid vee asemel tekib ammoniaak.
Kõige omapärasemaks nähtuseks ammoniaagi puhul võiks pidada leelismetallide lahuseid, mis on erilised just oma struktuuri, mille põhjustavad ammoniaagi poolt solvateeritud elektronid ja katioonid, kõrge juhtivuse ja värvuse poolest.
Ammoniaagi näol on tegu huvitava solvendiga, mis ühest küljest on veega justkui väga sarnane, teisalt aga võivad selles aset leida nähtused, mida vees sellisel kujul ei esine.
Kasutatud kirjandus
Ahmetov N. (1974) Anorgaaniline keemia. Valgus, Tallinn.
Atkins P, Overton T., Rourke J., Weller M., Armstrong F., Hagerman M. (2010) Inorganic Chemistry. W. H. Freeman and Company, New York.
Douglas B., McDaniel D., Alexander J. (1993) Concepts and Models of Inorganic Chemistry. Wiley, New York.
Housecroft C. E., Sharpe A. G. (2005) Inorganic Chemistry. Pearson, Harlow.
Huheey J. E. (1975) INORGANIC CHEMISTRY: Principles of Structure and Reactivity. Harper & Row, London.
Karik H., Palm U., Past V. (1981) Üldine ja anorgaaniline keemia. Valgus, Tallinn.
King R. B. (2005) Encyclopedia of inorganic chemistry. Wiley, Chichester.
Lagowski J. J. (2007) Liquid Ammonia. SYNTH REACT INORG M. 37:2, 115-153.
Reichardt C. (2003) Solvents and Solvent Effects in Organic Chemistry. Wiley, Weinheim.
konspekt ainest “Füüsikaline keemia II”
http://www.nature.com/ncomms/journal/v4/n2/abs/ncomms2555.html
viimati vaadatud 01.11.14
http://www.worldofchemicals.com/chemicals/chemical-properties/ammonia.html viimati vaadatud 01.11.14
Lisa 1. Küsimused
Millised solvendi ja soluudi omadused ja miks on olulised ioonsete ühendite lahustumisel ammoniaagis?
Mis on ammonohapped ja – alused? Milliseid iseloomulikke reaktsioone nendega toimuda võib?
Mis on ammonolüüs? Tuua näitereaktsioone!
Mis toimub leelismetallide lahustumisel ammoniaagis? Kirjelda tekkinud lahuse omadusi!
Mis on solvateeritud elektronid? Kas neid võib ka vees esineda?
2
