Kordamisküsimuste vastused aines Kolloidkeemia
Lisamise aeg:
2015-08-14 11:38:41Vaatamiste arv:
18228Tagasiside:
5 0Kordamisküsimused aines Kolloidkeemia
Õppeaasta 2013/14 sügissemester
PINDPINEVUS/ADHESIOON/MÄRGUMINE/KAPILLAARSUS
Mis on dispersse süsteemi peenestusastme mõõduks?
Dispersse süsteemi peenestusastme mõõduks on dispersiooniaste: osakeste diameetri pöördväärtus. See on 1 m pikkust lõiku moodustavate osakeste arv.
Mis on pindpinevus, mis on selle ühikud?
Pindpinevus on ühikulise pinna vabaenergia. Seda võib vaadelda kui tööd, mida peab tegema molekulide toomiseks faasi sisemusest piirpinnale. See töö kulutatakse peamiselt molekulidevaheliste sidemete lõhkumiseks => mida tugevamad on molekulidevahelised jõud, seda suurem on pindpinevus. Ühik kas 1 N/m või 1 J/m2
Võrdväärne definitsioon: jõud, mida vaja rakendada pinna ühikuliseks suurendamiseks.
Kuidas sõltub pindpinevus aine loomusest?
Molekulidevahelised jõud, mis määravad pindpinevuse ning aine eksisteerimise kondenseeritud olekus: metalliline side, vesinikside, vdW jõud. Mida tugevamad on aineosakeste vahelised jõud(kohesioon), seda suurem pindpinevus.
Pindpinevus kui jõud, pindpinevus kui töö.
Pindpinevus pole iseseisev jõud, aga siserõhu toime resultaat.
Vabaenergia pinnaühiku kohta on võrdne rakendatud jõuga pikkusühiku kohta. Ehk vaadeldes pindpinevust jõuna – jõud, mida on vaja rakendada pinna ühikuliseks pikendamiseks.
Milliseid meetodeid kasutatakse pindpinevuse määramiseks?
Kapillaartõusu meetod
Mullikeste suurima rõhu meetod
Stalagmomeetriline meetod
Plaadi tasakaalustamise meetod
Rõnga lahtirebimise meetod
Millel põhineb pindpinevuse määramine kapillaartõusu meetodil?
Kapillaartõusu meetod: Vedeliku nivoo tõusu kapillaaris (võrreldes vedeliku nivooga laias nõus) põhjustab pindpinevusjõud? Kapillaarrõhk? mis on tasakaalus samba raskusjõuga. Äkki valemid ka?
Millel põhineb pindpinevuse määramine rõnga lahtirebimise ja stalagmomeetrilisel meetodil?
Rõnga lahtirebimise meetod- määratakse jõud, mis on vajalik rõnga lahtirebimiseks vedeliku pinnalt. Tavaliselt kasutatakse täpsete tulemuste jaoks paranduskoefitsenti, mis arvestab rõnga geomeetriat.
Stalagmomeetrilise meetodi korral loendatakse tilkade arv kindla ruumala vedeliku korral. Kui stalagmomeetri ruumala on V ja tilkade arv n, siis 1 tilga ruumala on V/n ning kaal V*ρ / n. Tilga eraldumise momendil on tilka ülal hoidev pindpinevusjõud võrdne tilgale mõjuva raskusjõuga
Millel põhineb mullikeste suurima rõhu meetod?
Mullikeste suurima rõhu meetod – vedelikku surutakse õhumull, gaas mullikese sees on õhurõhu ja vedeliku kapillaarse rõhu (p = 2*σ / r ) mõju all. Kuna raadiuse otse määramine on raske, siis määratakse tundmatu vedeliku pindpinevus vedeliku kaudu, mille pindpinevus on teada. Seega σ = k*p , kus k on seadme konstant, p kapillaarne rõhk. 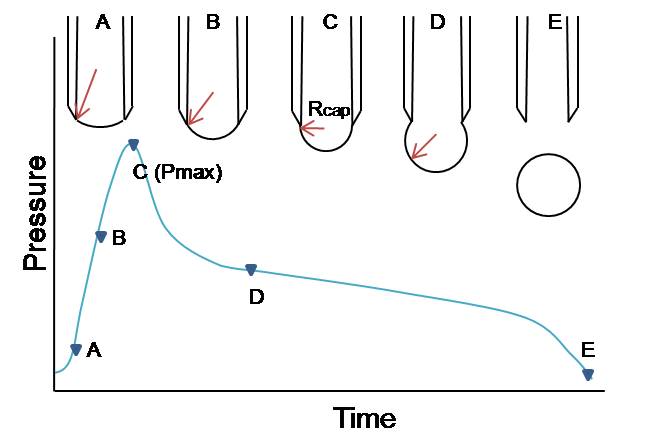
Kuidas ja miks sõltub pindpinevus temperatuurist?
Pinnaentalpia on suurem kui pinna vabaenergia pinna moodustumissoojuse võrra. (Kui osakesed liiguvad pinnale, siis saavad vähem liikuda (vähem erinevaid suundasid), nö temp väheneb, seega pinna moodustumine neelab soojust) Pinna moodustumissoojus indiviuaalsete ainete korral on positiivne suurus (VALEMEID).
Temperatuuri tõustes pindpinevus väheneb. Enamiku mittepolaarsete ainete korral on see sõltuvus lineaarne.
Paljude mittepolaarsete org vedelike korral moodust u poole pinnaenergiast entroopia (aine pindkiht on oma omadustelt gaasifaasile lähedasem kui ved sisemus)
Mida nimetatakse kohesiooniks ja adhesiooniks? Miks on need nähtused olulised? Milliseid parameetreid kasutatakse nende kvantitatiivseks iseloomustamiseks?
Kohesioon – molekulide-/aatomitevaheline külgetõmme faasi sees, INTERMOLEKULAARSED jõud. Kohesiooniga on määratud ainete esinemine kondenseeritud olekus ja seda põhjustavad osakestevahelised tõmbejõud. Ei mõjuta üksteist oluliselt ? Aditiivsed (nt vee korral liituvad dispersioonijõud ja vesiniksideme mõju)
Adhesioon – kondenseeritud faaside vahelistest vastaastikmõjudest tingitud seos (side). Adhesiooni tagajärjel tekib kehade vahele teatud tugevusega side. Adhesiooni mööt on pindade lahtirebimiseks kuluv töö pinnaühiku kohta (J/m2)
Kohesioon avaldab vastupanu aine dispergeerimisele.
Mida nimetatakse märgumiseks? Näidake seos adhesiooni ja vedeliku märgamisvõime vahel tahkel pinnal?
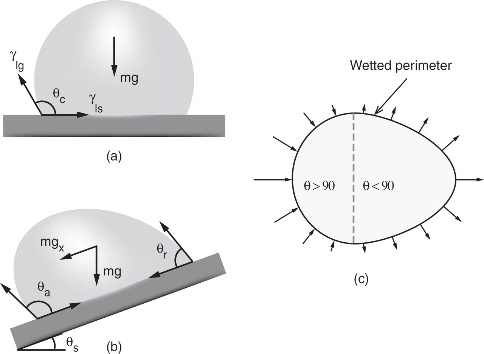 Märgumiseks nimetatakse kokkupuutepinnal toimuvaid protsesse, mis vähendavad süsteemi energiat; tahketel või vedelal pinnal ühe voolise asendumine teise voolisega. Märgumise perimeerer- 3 faasi kokkupuutejoon. Young’i võrrand: tahke-gaas pindpinevus on võrdne (tahke-vedelik pindpinevus + vedelik-gaas pindpinevus korrutatud märgumisnurga cos-ga)SEOS on kile 3 peal
Märgumiseks nimetatakse kokkupuutepinnal toimuvaid protsesse, mis vähendavad süsteemi energiat; tahketel või vedelal pinnal ühe voolise asendumine teise voolisega. Märgumise perimeerer- 3 faasi kokkupuutejoon. Young’i võrrand: tahke-gaas pindpinevus on võrdne (tahke-vedelik pindpinevus + vedelik-gaas pindpinevus korrutatud märgumisnurga cos-ga)SEOS on kile 3 peal
Kuidas mõjub tahke keha ja vedeliku loomus (molekulidevaheline vastasmõju) märgumisele ja adhesioonile?
Laialivalgumine toimub, kui adhesioonitöö ületab laialivalguva vedeliku kohesioonitöö.
Kui vedeliku kohesioon on suurem kui selle adhesion tahke pinnaga, siis vedelik pinda ei märga (äärenurk on üle 90 kraadi). Kui vedeliku sees on tugevad vastasmõjud (vesiniksidemed, metallilised sidemed) siis võibki taoline juht esineda. Samas kui vedeliku sees on nõrk kohesioon (dispersioonijõud, süsivesinikud), siis võib vedelik pinal jästi laiali valguda (piirnurk on alla 90 kraadi). Olulised on ka tahkise sees olevad sidemed.
Üldiselt – mida tugevam on ainete adhesion, seda paremini märgab.
Iseloomustage ja tooge näiteid hüdrofiilsete ja hüdrofoobsete pindade kohta?
Hüdrofiilne pind – vesi märgab seda paremini kui süsivesinikud, näiteks tahke KCl
Hüdrofoobne pind – süsivesinikud märgavad seda paremini kui vesi, näiteks parafiin, teflon
Millest on tingitud vee märgamisvõime paranemine hüdrofoobsetel pindadel kui lisada PAA vette?
Pindaktiivse aine molekulis on hüdrofiilne ots ja hüdrofoobne ots. See koguneb vee pinnale. Hüdrofiilsed otsd jäävad vee poole ja hüdrofoobsed väljapoole. Lahuse pindpinevus muutub PAA tõttu väiksemaks, sest alküülahelate-gaasi vaheline pindpinevus on väiksem kui vee ja gaasi vaheline pindpinevus.
Kuidas mõjub pinna kõverus ja aine loomus selle lisarõhule (siserõhule)? Millised on kapillaarse tõusu (languse) põhjused?
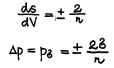 Täiendav lisarõhk on suunatud kõveruse tsentrisse. Mida suurem on pindpinevus, seda suurem on siserõhkude erinevus kumer- ja tasapinna korral ja dispersiooniastme suurenedes kasvab siserõhk kiiremini.
Täiendav lisarõhk on suunatud kõveruse tsentrisse. Mida suurem on pindpinevus, seda suurem on siserõhkude erinevus kumer- ja tasapinna korral ja dispersiooniastme suurenedes kasvab siserõhk kiiremini.
Siserõhkude erinevus kumer- ja tasapinna korral = kapillaarne rõhk
Pindpinevus põhjustab rõhkude erinevuse kõvera pinna korral. See lisarõhk on positiivne kumera pinna korral ja negatiivne nõguse pinna korral. Lisarõhk sõltub vedeliku pindpinevusest ja pinna kõverusest
Millest on tingitud piiskade sfääriline kuju kaaluta olekus?
Mida väiksem on tilga raadius, seda suurem on osakeste tung lahuse sisemusse. Pindrõhu (e kapillaarse rõhu) kasvamine kõverusraadiuse vähenedes põhjustab tilkade sfäärilise kuju- tilk püüab saavutada minimaalset eripinda.
Tilkade sfääriline kuju on tingitud pindkihi molekulide püüdest liikuda faasi sisemusse ja seega viia vedeliku pind minimaalseks.
(Et võimalikult vähesed molekulid peaksid kogema nõrki vastasmõjusid gaasifaasiga)
Kuidas mõjub aine dispersioon tema reaktsioonivõimele, aururõhule, lahustuvusele ja tasakaalukonstandile vastavates reaktsioonides?
Mida kõveram on pind, seda reaktsioonivõimelisem. Tasakaalulise reaktsiooni korral reageerivad enne ära väikemad reagendi osakesed ja pöördreaktsiooni tõttu kasvavad suuremad.
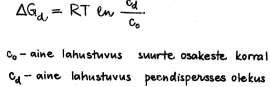 Kumerpinnal on aururõhk seda suurem, mida väiksem on kõverusraadius, nõguspinnal aururõhk väheneb kõverusraadiuse vähenedes.
Kumerpinnal on aururõhk seda suurem, mida väiksem on kõverusraadius, nõguspinnal aururõhk väheneb kõverusraadiuse vähenedes.
Tilga raadiuse vähenedes vähenevad sulamis- ja aurustumistemperatuurid
Peendispersses olekus- kui osakesed selle sama aine küllastunud lahuses siis väiksemate osade pealt lahustub ja suurematele sadeneb.
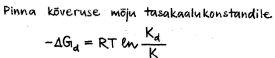 Tasakaalukonstant suuremaks?
Tasakaalukonstant suuremaks?
Väiksematelt osakestelt reageerib aine kiiremini ära kui suurematelt. Üldist reaksiooni tasakaalukonstanti ei mõjuta!
Miks kondenseerub aur kapillaarides madalamal rõhul kui tasapinnal?
Sellepärast et kumera pinnaga aurustub madalamal rõhul => ka kondenseerub madalamal rõhul.
Mis on Harkinsi koefitsient? Millised on vedelike laialivalgumise tingimused? Millised eripärad on vedelike laialivoolamisel tahkel pinnal?
Harkinsi koefitsent ehk laialivalgumistöö – adhesioonitöö miinus kohesioonitöö.
Ehk laialivalgumine toimub, kui adhesioonitöö ületab laialivalguva vedeliku kohesioonitöö. Pindpinevuste kaudu => tahke-gaas pindpinevus on suurem kui (tahke-vedelik pluss vedelik-gaas pindpinevus)
Tahke aine märgumisele avaldab suurt mõju tahke aine pinna olek (selle koredus). Kui tõeline pind on suurem ideaalselt siledast pinnast, siis on tegu koreda pinnaga. Pinna koredus soodustab märgumist, kui tegu on märguva pinnaga. Mittemärguva korral vähendab koredus märgumist veelgi. Märgumisel esineb samuti hüstereesinähtus ehk vedelikutilk, mis on kontaktis tahke ainega võib moodustada mitu stabiilset äärenurka (äravoolunurk, pealevoolunurk).
Millest on tingitud Hg halb märguvus enamikul pindadel?
Sellepärast, et tugeva metallilise sideme tõttu on elavhõbedal erakordselt suur pindpinevus ja ka väga suured kohesioonijõud.?
ADSORPTSIOON
Defineerige järgmised mõisted: adsorptsioon, adsorbent, adsorbaat, adsorptsiooni isoterm.
Adsorptsioon – isevooluliselt kulgev komponentide kogunemine faaside piirpinnale
Adsorbent – aine, mille pinnale toimub komponendi kogunemine
Adsorbaat – aine, mis koguneb faasidevahelisele piirpinnale
Adsorptsiooni isoterm – sõltuvus Gibbsi pindliia ehk komponendi pindliia pindkihis (või täitumisastme) ja kontsentratsiooni (või osarõhu) vahel kui temperatuur on konstantne.
Mis tingimustel vastab adsorptsiooniprotsess Henry seadusele? Milline on Henry konstandi füüsikaline sisu?
Adsorptsiooniprotsess vastab Henry seadustele siis, kui adsorbaadi kontsentratsioon/rõhk on väike. Henry konstant on maksimaalne Gibbsi pindliig korrutatud adsorptsiooni tasakaalukonstandiga. Γmax*k. ??? = g /(RT)
Milline on Langmuiri adsorptsioonivõrrand? Milline on selle konstandi füüsikaline sisu?
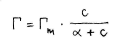 konstant α on arvuliselt võrdne rõhuga, mille korral Γ =0,5*Γmax
konstant α on arvuliselt võrdne rõhuga, mille korral Γ =0,5*Γmax
Seda võib määrata graafiliselt.
Mille poolest erinevad Langmuiri ja Henry adsorptsioonikonstandid ja milline on nendevaheline seos?
Henry adsorpsioonikonstant on g /(R*T), Langmuir pöördväärtus adsoptsiooni tasakaalukonstandist.
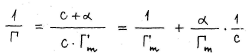 Kuidas leitakse Langmuiri võrrandi konstante? Milliseid termodünaamilisi ja geomeetrilisi suurusi saab nende konstantide abil leida?
Kuidas leitakse Langmuiri võrrandi konstante? Milliseid termodünaamilisi ja geomeetrilisi suurusi saab nende konstantide abil leida?
Konstantide leidmiseks kirjutatakse võrrand kujule 1/Γ Selle abil saab määrata maksimaalset täitumisastet, aga ka pinna, mille võtab enda alla 1 molekul s0 ja ka adsorbeerunud molekuliahela pikkuse l0
Mis on pindaktiivsus? Milliseid aineid nimetatakse pindaktiivseteks? Mis on pindaktiivsuse g füüsikaline sisu? Mis on g ühik?
Pindaktiivsus on aine omadus kontsentratsiooni suurenedes vähendada lahuse pindpinevust. Pindaktiivseteks nim neid aineid, mille kontsentratsioon on pindkihis suurem kui faasi sisemuses.
G on piirväärtus pindpinevuse tuletisest kontsentratsiooni järgi kui kontsentratsioon läheneb 0le. G ühik on J*m/mol.
Milline võrrand seob pindpinevust pindaktiivse aine (PAA) lahuses kontsentratsiooniga? Kuidas saab pindpinevuse isotermilt leida adsorbeerunud aine hulka?
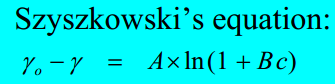 Siin on pindpinevus tähistatud gammaga. Langmuir tuletas selle valemi hiljem välja toodud konstantidega – A on R*T*Γm ja B on adsorptsiooni tasakaalukonstant k
Siin on pindpinevus tähistatud gammaga. Langmuir tuletas selle valemi hiljem välja toodud konstantidega – A on R*T*Γm ja B on adsorptsiooni tasakaalukonstant k 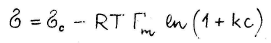
Kuidas adsorbeerunud aine hulk?Mis on pindpinevuse isoterm?
Formuleerige Traube reegel ja selgitage selle füüsikaline sisu.
Tasakaalukonstant k ja pindaktiivsus g kasvavad 3 – 3,5 korda, kui ahel pikeneb homoloogilises reas 1 lüli (-CH2-) võrra. See tuleneb sellest, et adsorptsioonitöö iga CH2 rühma kohta on kostantne suurus, mille ligikaudne väärtus on 3 kJ/mol. CH2-rühma väljasurumine vee poolt põhjustab ka lahustumise vähenemise pikemate SV ahelate puhul.
Näidake seos Henry adsorptsioonikonstandi ja pindaktiivsuse vahel.
Henry konstant on pindaktiivsus g /( R*T). Pindaktiivsus on piirväärtus pindpinevuse tuletisest kontsetratsiooni järgi kui kontsentratsioon läheneb 0le ehk esialgse sõltuvuse tõusunurga tangens.
Kuidas leida adsorbse kihi paksus ja PAA poolt hõlmatav pindala teades pindpinevuse sõltuvust lahuse kontsentratsioonist?
Gibbsi adsorptsioonivõrrand annab pindliia, kui on teada pindpinevuse sõltuvus kontsentratsioonist. Pindliia kaudu peaks teada saama hõivatud pindala? Kas siin on need s0 ja l0 mängus?
Mis vahe on Langmuiri ja Freundlichi adsorptsioonivõrranditel?
Langmuiri isoterm eeldab, et kõik adsorptsioonitsentrid on võrdsed ja adsorptsioonienergia on kõigil tsentritel ühesugune. Kuna aga sageli on adsorptsioonitsentrid erineva aktiivsusega ning varieerub ka adsorpsioonientalpia, siis täitumisastme kasvades adsorptsioonientalpia väheneb. Freaudlichi
Mis on suuruse ?max?M füüsikaline sisu? Põhjendada võrdsus ?max?M=lo?d
EI TEA!!!
Mille poolest erineb adsorptsioon lahustest gaaside ja aurude adsorptsioonist?
Kui toimub adsorptsioon lahusest, siis kasutatakse kontsentratsioone, kui gaasifaasist, siis osarõhkusid. Kui toimub adsorptsioon gaasifaasist tahkisele, siis on oluline veel märkida, et tahkise pinnal pole adsorptsioonitsentrid võrdsed, mõned tsentrid on energeetiliselt palju soodsamad kui teised. Adsorptsioonil lahuses tuleb kõrvuti adsorbendi ja adsorbaadi vahelise vastastikuse toimega arvestada ka molekulaarjõude vedelfaasis. Adsorptsioonil lahustest tuleb arvestada vähemalt 2komponendiga (lahusti +lah aine on pinnal)
Mis on negatiivne Gibbsi adsorptsioon?
See kui aine aktiivsuse kasvades lahuses pindpinevus kasvab ehk tegu on pindinaktiivse ainega.
Mida nimetatakse vahetusadsorptsiooniks?
Vahetusadsorptsiooniks nimetatakse protsessi, kus lahuses leiduvad hästi adsorbeeruvad ioonid tõrjuvad pinnalt välja ekvivalentse koguse seal varem adsorbeerunud ioone.
Mida kujutavad endast ioonvahetusadsorbendid (ioniidid)?
Ioniidiks nimetatakse adsorbenti vahetusadsorptsioonil. Need on adsorbendid, mis saavad vahetada lahusega ioone. Kationiidi puhul vahetuvad katioonid, anioniidi puhul vahetuvad anioonid.
Milline on veepuhastusprotsess kationiitide ja anioniitide abil? Kuidas kasutada ioniite vee kareduse vähendamiseks?
 Ioonide madala kontsentratsiooni korral seovad ioniidid paremini mitmelaengulisi ioone. Seega kuna looduslikus magevees on ioonide kontsentratsioon piisavalt madal, siis vahetavad veel leiduvad Ca ja Mg ioonid kationiidis leiduva Na välja.
Ioonide madala kontsentratsiooni korral seovad ioniidid paremini mitmelaengulisi ioone. Seega kuna looduslikus magevees on ioonide kontsentratsioon piisavalt madal, siis vahetavad veel leiduvad Ca ja Mg ioonid kationiidis leiduva Na välja.
Vee puhastamisel ioonidest (MilliQ vee jaoks näiteks) vahetavad vees olevad Na ioonid H välja ja Cl ioonid OH välja, ning tekib vesi.
Milliste adsorbentide korral kasutatakse kapillaarse kondensatsiooni teooriat, millised on selle teooria lähtealused?
Aktiivsöe korral? Väga suure eripinnaga poorsete adsorbentide korral.
Kapillaarne kondensatsioon – aurud kondenseeruvad kapillaaris madalamal tempertuuril kui tavaliselt
Milliseid olekuvõrrandeid kasutatakse gaasitaoliste adsorbsete kilede korral? Kuidas neis arvestatakse molekulide omamõõtmeid ja vastasmõju?
Ideaalgaasi kahedimensionaalset analoogi? Rõhku asendab seal vastav pindrõhk ja ruumala asendab 2dimensiooniline ruumala (1 mol adsorbeerunud aine hõivatud pindala). Madalate kontsentratsioonide juures selline lähenemine sobib, kõrgemate juures tuleb sisse tuua parandusliikmed (lk 73 lõpp “Pindnähtused ja adsorptsioon”)
Milliseid adsorbaate kasutatakse eripinna määramisel Brunauer-Emmet-Telleri (BET) meetodi korral? Millistel tingimustel toimub eripinna määramine?
Mittepolaarseid gaase? Populaarne valik on N2 77 K ehk vedela lämmastiku temperatuuri juures. Veel kasutatakse krüptooni 77 K juures, selle puhul on tegu väiksema eripinnaga materjalidega.
Kuidas leitakse BET-i võrrandi konstandid?
BET esialgne võrrand lineariseeritakse: 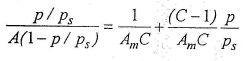 algordinaadist leitakse 1/(AmC) ja tõusu väärtusest C-1
algordinaadist leitakse 1/(AmC) ja tõusu väärtusest C-1
DISPERSSETE SÜSTEEMIDE ELEKTRILISED OMADUSED
Millised on võimalikud põhjused elektrilise kaksikkihi moodustumiseks faasidevahelisel piirpinnal? Tooge näiteid elektrilise kaksikkihi moodustumisest erinevates süsteemides.
Laeng faasidevahelisel piirpinnal võib tekkida:
kui laetud osakesed adsorbeeruvad
kui toimub pinddissotsiatsioon
mõjub väline vooluallikas
Laetud osatesed võivad adsorbeeruda nt tekkinud soolakristallile, siis kui ühte iooni on lahuses suures liias.
Pinna dissotsieerumine – nt polümeer, kus on karboksüülhapperühmi
Iseloomustage elektrilist kaksikkihti faasidevahelisel piirpinnal. Kuidas muutub potentsiaal pinnast kaugenemisel?
Pinnast kaugenemisel potentsiaal väheneb. Iseloomusta elektrilist kaksikkihti??
Sõnastage elektrilise kaksikkihi teooria põhiseisukohad (Gouy-Chapmani ja Sterni mudelid).
Gouy-Chapman: Ioonide jaotus difuusses kihis allub Boltzmanni statistilisele jaotusseadusele: tahke faasi pinna lähedal moodustub ioonatmosfäär Potentsiaal väheneb ühtlaselt.
Stern: kaksikkiht koosneb kompaktsest kihist- Helmholtzi kihist ja difuussest Gouy kihist.
Mida mõeldakse elektrilise kaksikkihi difuusse osa paksuse all? Millega määratakse elektrilise kaksikkihi tiheda (Helmholtzi) ja difuusse (Gouy) osa paksused?
Tekitades lahusesse elektivälja, siis hakkavad graanulad liikuma ja jätavad kaugemad difuusse kihi osad maha. Difuusse kihi paksus – selle kihi paksus (alates graanulast) milles elektriline potentsiaal saab 0ks.
Kompaktse kihi korral potentsiaali tuletis kauguse järgi pinnast on konstante 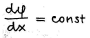 (sirge), selles kihis vedelik ei liigu
(sirge), selles kihis vedelik ei liigu
Difuusse kihi korral pole konstantne 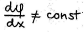 , selles kihis vedelik liigub
, selles kihis vedelik liigub
Loetlege elektrokineetilised nähtused ja selgitage, millest need on tingitud?
Jagunevad laias laastus 2ks:
Elektriväli põhjustab faaside ümberpaiknemist
ELEKTROOSMOOS: keskkond liigub disperse faasi suhtes
ELEKTROFOREES: dispersse faasi osakese liiguvad välise välja toimel
Faaside ümberpaiknemine tekitab potentsiaalierinevuse
SETTIMISPOTENTSIAAL: liigub tahke faas; suspensioonides ja emulsioonides tekib pihusfaasi settimise tulemusel süseemi eri kõrgustel potentsiaalierinevus
VOOLAMISPOTENTSIAAL: liigub vedel faas; tekib poorse membraaniga eraldatud 2 suspensiooni vahel, kui suruda vedelikku läbi membraani
Mis määrab elektrokineetiliste protsesside intensiivsuse?
Keskkonna dielektriline konstant, välise elektrivälja tugevus, viskoossus 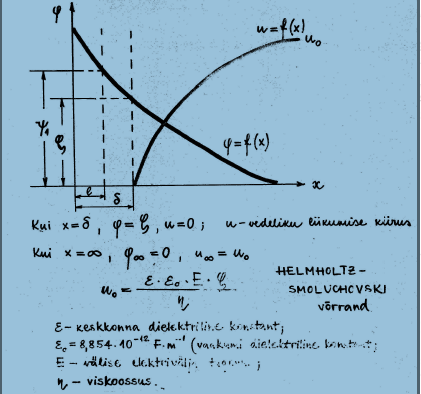
Mida nimetatakse elektrokineetiliseks potentsiaaliks? Millised faktorid mõjutavad elektrokineetilise potentsiaali väärtust? Kuidas muutub ?-potentsiaal negatiivselt laetud osakestel, kui viia sooli KNO3, Ba(NO3)2 ja La(NO3)3?
Elektrokineetiline potentsiaal: potentsiaal sellisel kaugusel piirpinnast, kus vedel faas hakkab liikuma tahke faasi suhtes.
Elektrokineetilist potentsiaali mõjutavad:
Temperatuur: difuusne osa kasvab ja el kin pot suureneb, samas potentsiaali määravate ioonide desorptsioon temp kasvades tõusebb ja selleläbi el kin pot väheneb
Lahjenduse mõju: difuussus suureneb => el kin pot suureneb; pot määrvate ioonide desorptsioon kasvab ja seega el kin pot väheneb
pH mõju on oluline, kui dispersne faas on amfoteerne (nõrgad alused) 
Lisandid:
Kui lisatav el lüüt ei sisalda laengut määravaid ioone (ega nendega sarnaseid, indiferentne elektrolüüt). Adsorbsesse kihti ioone ei lähe ja pot ei muutu
Kui ei sisalda ka spets ads ioone, siis dif kiht surutakse kokku, el 2kihi paksus väheneb, ja ka el kin pot väheneb
Kui sis spets ads ioone, siis toimub kolloidosakese ümberlaadumine ja el kin pot saab vastupidise märgi, lisaks surutakse ka 2kiht kokku.
Lisatav el lüüt sis osakese laengut määravaid ioone või nendega sarnaseid ioone. Sellise elektrolüüdi lisamine mõjub kahel moel
Elektrilisse kaksikkihti läheb juurde laengut määravaid ioone ning φ suureneb
Elektrolüüdi lisam põhj dif kihi kokkusurumise (eriti suuremate lisandikoguste korral), el 2kihi paksus väheneb ja ka el kin pot väheneb
Koaguleeriva toimega on tavaliselt see ioon, mis on laengult vastsmärgiline kolloidosakese potentsiaali määrava iooni laengule, toime on seda suurem, mida suurem on koaguleeriva osakese laeng. Kui koaguleerivad ioonid on sama laenguga, siis on koaguleeriv toime seda suurem, mida vähem on ioon solvateeritud, ehk mida suurema raadiusega (vesilahuse korral).
Selgitage pinna ümberlaadumise nähtust?
Lisades süsteemi elektrolüüti, milles sisalduv ioon adsorbeerub spetsiifiliselt kolloidosakese tuumal. Põhimõtteliselt tekib uus kiht neutraalset ainet tuuma pinnale ja kuna suguluses olevat vastasmärgiga iooni on ikka veel lahuses rohkem, siis see adsorbeerub pinnale ja graanula laeng muutub), siis kolloidosakese laengu märk muutub ja samuti potentsiaali märk muutub. 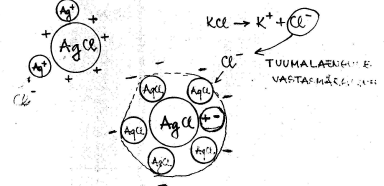
Mida kujutavad endast relaksatsiooniefekt ja elektroforeetiline pidurdus?
EI TEA; EI LEIDNUD!!!
DISPERSSETE SÜSTEEMIDE OPTILISED OMADUSED
Millised optilised nähtused ilmnevad valguse langemisel disperssele süsteemile? Millised uurimismeetodid põhinevad nendel nähtustel?
Kui valguskiir langeb disperssele süsteemile, siis:
Valgus läbib dispersse süsteemi – iseloomulik värvitutele molekulaarse/ioonse dispersiooniastmega süsteemidele; Turbidimeetria: põhineb dispersset süsteemi läbiva valguse intensiivsuse mõõtmisel
Valgus murdub dispersse süsteemi osakestes – iseloomulik mikroheterogeensetele süsteemidele
Valgus peegeldub dispersse faasi osakestelt – iseloomulik mikroheterogeensetele süsteemidele
Valgus hajub difraktsiooni tõttu – iseloomulik kolloididele- Nefelomeetria: määratakse hajutatud valguse intensiivsust; Ultramikroskoopia: hajumine küljele
Valgus neeldub dispersses süsteemis – iseloomulik kolloididele
Milliseid optilisi meetodeid kasutatakse disperssete süsteemide mõõtmete määramisel?
Hajumist, läbimist.
Nefelomeetria: põhineb hajutatud valguse intensiivsuse määramisel; saab tänu Rayleigh’ võrrandile määrata nii osakeste kontsentratsiooni kui ka osakeste suurust, mõlemaga võrdeline seos? (hajutatud valguse intensiivsuse sõltuvus osakese raadiusest on maksimumiga graafik- väga väikest osakeste korral on intensiivsus liiga väike)
Turbidimeetria: põhineb dispersset süsteemi läbiva vlgus intensiivsuse mõõtmisel. Arvestatakse, et intensiivsuse vähenemise tingib hajumine, neeldumine
Ultramikroskoopia: hajumine külje pealt; eriti väikeste osakeste jaoks
Millist infot dispersse süsteemi kohta annavad osakeste mõõtmete diferentsiaalne ja integraalne jaotuskõver?
Millest on tingitud valguse hajumine disperssetes süsteemides ja tõelistes lahustes? Milliste parameetritega iseloomustatakse kvantitatiivselt valguse hajumist?
Juhtides valgust läbi isotroopse homogeense keskkonna, valgus ei haju, sest kui lainefront jõuab selles keskkonnas mingi punktini, siis võib seda punti vadelda kui uut võnkumise allikat. Sekundaarlained kiirguvad vaid ettepoole (teistes suundades kustuvad). Seega laine geomeetriline kuju ei muutu. Kui aga laine teele jab ebaühtlus, siis muutub see ebaühtluse koht iseseisvaks laineallikaks. Tekib lainefront, mille suund muutub sõltuvalt ebaühtluse suurusest. Kui ebaühtlus on suurem kui lainepikkus, siis märkame peegeldumist. Kui lainepikkus on ebaühtlusega samas suurusjärgus, siis toimub difraktsioon ja hajumine kõigis suundades.
Hajunud valguse intensiivus või hägusus?
Mille poolest erinevad nefelomeetria ja turbidimeetria meetodid?
Nefelomeetria põhineb valguse hajumise intensiivsuse mõõtmisel, turbidimeetria läbimise intensiivsuse mõõtmisel.
Milliste disperssete süsteemide korral kasutatakse Rayleigh valemit?
(Suuremate süsteemide korral on mitmekordne hajumine ja valemisse tuleb sisse viia parandusliige) Rayleigh võrrand pole kasutatav nende kolloidide jaoks, kus dispersse faasi moodustavad elektrit juhtivad osakesed
Milles seisneb ultramikroskoopilise meetodi eripära? Milliste disperssete süsteemide korral seda kasutatakse?
Seda kasutatakse osakeste korral, mis on nähtava valguse lainepikkusest väiksemad. Kuna osakesed on väisked, siis hajub väga vähe valgust. Seetõttu valgustatakse dispersset süsteemi intensiivse valgusallikaga ja hajumise intensiivsust mõõdetakse küljelt? Võimaldab konstanteerida osakeste olemaslu ja jälgida nende liikumist?
Millised on elektronmikroskoopia eelised ja puudused disperssete süsteemide osakeste mõõtmete määramisel?
KOLLOIDSÜSTEEMID, NENDE VALMISTAMINE JA PUHASTAMINE
Mida nimetatakse dispersseteks süsteemideks? Mille poolest on disperssed süsteemid olulised/unikaalsed? Tooge näiteid erinevatest disperrsetest süsteemidest.
Dispersne süsteem: süsteem, mis koosneb vähemlt 2 komponendist, millest üks on väikeste osakestena jaotatud teises.On erilised, kuna pinnaenergia osa süsteemi koguenergias on suur; palju faasidevahelist pinda.NÄITED
Mille alusel klassifitseeritakse kolloidsüsteeme?
Osakeste mõõtmete alusel:
Jämedisperssed: suspensioonid, emulsioonid
Kolloiddisperssed: soolid
Molekulaarsed ja ioondisperssed süsteemid
Faaside agregaatolekute alusel
Dispersioonikeskkonna ja dispersse faasi osakeste vahelise mõju alusel
Lüofoobsed: disp faafi ja dispersioonikeskkonna vahelised jõud on nõrgad
Lüofiilsed: disp kk ja disp faasi mõjujõud on suured; saadakse kmü-de lahustamisel
Milliseid meetodeid kasutatakse kolloidsüsteemide valmistamiseks?
Jagunevad:
Kondenseerimismeetodid: eesmärk liita väisemaid osakesi suuremateks agregaatideks; energeetiliselt soodsam; 1)keskmete teke; 2) keskmete kasv
Lahusti vahetamise meetod
Aurude kondensatsioonimeetod
Keemilise kondensatsiooni meetod
Dispergeerimismeetodid: eesmärk suuremate osakeste pihustamine väiksemateks
Mehaaniline peenestmine
Elektrisädeme/kaare abil
Ultraheliga pihustamine
Keemiline dispergeerimine e peptisatsioon
Miks on tarvis kolloidsüsteeme puhastada? Milliseid meetodeid selleks kasutatakse?
Üleliigsed elektrolüüdid tuleb eemaldada, sest enamikul juhtudel need vähendavad kolloidlahuste püsivust ning segavad nende uurimist.
Meetodid:
Dialüüs
Ultrafiltreerimine
Elektrodialüüs
Millel põhinevad dialüüs, ultrafiltratsioon, elektrodialüüs?
Dialüüs: kolloiddispersne aine eraldatakse ioon-(molekulaar-)disperssetest ainetest poolläbilaskvate membraanide abil
Elektrodialüüs: dialüüs, mida on kiirendatud elektroodidega
Ultrafiltreerimine: filtreerimine läbi väikesepooriliste membraanide. Need filtrid ei lase läbi kolloidosakesi- makromolekule, aga lasevad läbi lahusti jm madalmolekulaased ühendid. Filtrid samad, mis dialüüsil. Protsessi kiirendamiseks tehakse seda rõhu allKasutatakse ka kolloidlahuste kontsentreerimiseks.
MOLEKULAAR-KINEETILISED NÄHTUSED
Millest on tingitud dispersse süsteemi osakeste Browni liikumine? Tooge näiteid Browni liikumise kohta.
Osakeste liikumise suund pidevalt muutub, sest selle vastu põrkavad pidevalt suvalised teised osakesed.
Milline on osakeste Browni liikumise ja keskkonna molekulide soojusliikumise vaheline kvantitatiivne seos? Kuidas saab leida Avogadro arvu selle seose põhjal?
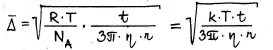 η – on keskkonna dünaamiline vikoossus
η – on keskkonna dünaamiline vikoossus
Kuidas võib leida dispergeeritud osakeste mõõtmeid või kontsentratsiooni lüosoolides osmootse rõhu kaudu?
Millised on Teile tuntud dispersioonanalüüsi meetodid (so. meetodid, mille abil saab leida osakeste dispersiooniastet)?
Kirjutage sedimentatsioonikiiruse valem gravitatsiooniväljas? Milline füüsikaline sisu on selle võrrandi liikmetel? Milliste parameetrite muuutmisega saab muuta osakeste settimiskiirust?
Milline näeb välja settimiskõver (m=f(t)) mono-, bi- ja polüdisperssete süsteemide korral?
Kui suuri osakesi (millises suuruste vahemikus) saab leida sedimentatsioonil?
Kuidas määrata osakeste sisaldus antud raadiuste vahemiku jaoks integraalsel ja diferentsiaalsel jaotuskõveratel?
Milliste disperssete süsteemide korral kasutatakse sedimentatsioonanalüüsi kesktõukejõuväljas? Millest sõltub osakese liikumise kiirus sedimentatsioonil kesktõukejõuväljas?
Mis on difusioonilis-sedimentatsiooniline tasakaal?
Mis põhjustab Donnani membraantasakaalu esinemise? Milline on difundeeruvate ioonide jaotus Donnani membraantasakaalu korral?
Donnani membraantasakaal esineb, kui ühte anumasse soola lahus, teise ühend, mille anioonid (katioonid) ei läbi membraani. Kuna suure aniooniga lahuses Cl ione pole, siis hakkavad need soolalahusest teise anumasse difundeeruma. Elektroneutraalsuse säilimiseks peavad ka Na+ ioonid difundeeruma.
LÜOFIILSETE DISPERSSETE SÜSTEEMIDE OMADUSED
Millise tunnuse alusel jaotatakse disperssed süsteemid lüofiilseteks ja lüofoobseteks? Millega selgitada faasidevahelise piirpinna iseeneslikku suurenemist lüofiilsete disperssete süsteemide moodustumisel?
Disperssed süsteemid jaotatakse lüofiilseteks ja lüofoobseteks dispersse faasi ja dispersioonikeskkonna omavahelise mõju alusel. Vabaenergia juurdekasv dispergeerimisel kompenseeritakse energiaga, mis saadakse entroopia suurenemise tõttu ning kuna osake satub Browni liikumisse. (See on võimalik, kuna faasidevaheline pindpinevus on väiksem kriitilisest väärtusest)
Millist parameetrit kasutatakse süsteemi lüofiilsuse iseloomustamisel?
Millised on lüofiilsed disperssed süsteemid (tooge näiteid)?
KMÜ lahused, tärklis vees, PAA-de lahused
Mille poolest erinevad kolloidsed PAA-d tõeliselt (molekulaarselt) lahustunud PAA-dest? Mida nimetatakse mitselli moodustumise kriitiliseks kontsentratsiooniks (MMKK)?
Kolloidsed PAAd sisaldavad mitselle. MMKKks nimetatakse kontsentratsiooni, mille juures moodustuvad mitsellid
Milliseid meetodeid kasutatakse MMKK määramiseks? Miks PAA kontsentratsioonidel, mis ületavad MMKK väärtuse, PAA lahuste pindpinevus ei muutu?
Mõõdetakse mingi füüsikalise omaduse, mis sõltub mitsellide olemasolust, väärtust sõltuvalt PAA kontsentratsioonist. Levinumalt mõõdetakse pindpinevust. Elektrijuhtivust ja värvilahustuvust?. Samuti on võimalik mitselle määrata dünaamilise valguse hajumisega?
Millised tegurid mõjutavad MMKK väärtust? Miks ja kuidas mõjutab süsivesinikahela pikkus MMKK väärtust erineva polaarsusega lahustites?
Ahela suurenedes muutub mitsellide moodustumine soodsamaks, see efekt kehtib kuni 18C –ni , pärast seda püsib MMKK suhteliselt konstantne. (polaarsete lahustite korral)
MMKK kasvab kui temperatuur kasvab. (Temperatuur ei soodusta mitsellide moodustumist)
Iooniliste mitsellide korral vähendab elektrolüütide lisamine lahusessse mitsellipinnal olevate laengute tõukumist ja seega vähendab MMKK
Orgaaniliste molekulide lisamine mõjutab MMKK mitmel moel. Enim mõju avaldavad need molekulid, mis kaasatakse mitselli väliskihti ja mis vähendavad elektrostaatilist tõukumist või steerilist pinget.2 erineva PAA segus moodustuvad mitsellid tavaliselt madalama konts juures
Kuidas orienteeruvad PAA molekulid mitsellides, mis on moodustunud polaarses ja mittepolaarses keskkonnas? Millest sõltub mitselli kuju kolloidse PAA lahustes?
Mitselli kuju sõltub PAA kujust, ehitusest, kontsentratsioonist, lahustist polaarsusest?
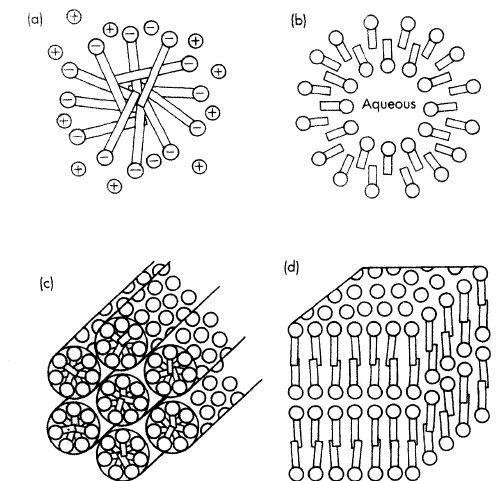
Kuidas mõjutab PAA polaarne rühm MMKK väärtust? Milline on elektrolüütide mõju MMKK väärtusele ionogeensete ja mitteionogeensete PAA-de korral?
Juba kirjas.
Milles avaldub seos PAA pindaktiivsuse ja mitsellimoodustumisvõime vahel?
Millist nähtust nimetatakse solubilisatsiooniks? Millest on see tingitud? Kus seda nähtust praktiliselt kasutatakse?
PAA aine lahused kontsentratsiooniga üle MMKK lahustavad molekule, mis puhtas vees praktiliselt ei lahustu. Need molekulid lahustuvadmitselli sees.Seda efekti kasutatakse paljudes kohtades, kus on vaja vees mittelahustuvaid ühendeid vesilahusesse viia. See on samuti see efekt, millel põhinevad detergendid.
Millel põhineb PAA kasutamine disperssete süsteemide stabiliseerimisel? Milles seisneb PAA pesemisvõime?
Millised on polümeeride lahustumise iseärasused? Millist protsessi nimetatakse pundumiseks? Millistel juhtudel esineb polümeeri piiratud ja piiramatu pundumine?
Lahustumise alguses tungib lahusti polümeeri ahelate vahele, polümeer pundub ja siis lõpuks jõuab polümeer lahusesse. Geelide moodustumine polümeeride lahustes.
Mis on pundumisaste ja kuidas seda määratakse?
Pundumine on lahusti neeldumine polümeeris, sagedasti ettetulev nähtus. Pundumisaste polmeeri massi muutus pundumisel jagatud esialgse massiga. Piiramatu pundumine lõppeb aine lahustumisega. Pundumisaste algul kasvab kiiresti, piiratud pundumisel hakkab ühest hetkest pundum.. Piiramatul pundumisel ajast sõltuvusel on maksimum- polümeer hakkab lahustuma.
Kuidas mõjutab lahuse pH polüamfolüütse KMÜ pundumisastet? Mida iseloomustab polüelektrolüütide isoelektriline täpp?
Isoelektrilise oleku juures on pundumisaste väiksem kui enne ja pärast seda. (Neeldunud vedelikukogus on väiksem). Elektrostaatiline tõmbumine ahela eri osade vahel hoiab seda koos (muidu on ahelatevaheline tõukumine valdav ja polümeer suurem.
Milliste tegurite tõttu suureneb disperssete süsteemide agregatiivne stabiilsus KMÜ lisamisel?
Milliseid dispersseid süsteeme nimetatakse geelideks? Millised faktorid soodustavad geelide moodustumist? Millised on geelide põhilised omadused ja kasutusalad?
Geel- struktureeritud süsteem, mis sisaldab pidevat ruumilist võrgustikku, millesse on seotud lahusti, kaob voolavus. Geel võib moodustuda juba ka väga väikeste konts korral – geelistumise kriitiline kontsentratsioon (sõltub ka temperatuurist).
Kui kõrgemal temperatuuril on vedelik, need pöörduvad geelid, pöördumatu geel- ristseosed (esimest ja teist tüüpi geelid). Millisest pundumisastmest alates nim geeliks? Kasutatakse palju farmaatsiatoodetes-
Milliseid nähtusi nimetatakse tiksotroopiaks ja sünereesiks?
Tiksotroopia- nähtus, kus füüsikalise geeli (vdW, vesiniksidemed..) segamisel (mehhaaniliselt töödelda), muutub geel pöörduvalt vedelaks (ehk kui lasta seista, siis tagasi geel). Tiksotroopne värv- ei kuku laest alla, ei tilgu. Sünerees- pöördumatu protsess geeli vananemisel, mille juures algne vorm säilub, aga struktuur korrapärastub, võrgustik surutakse kokku ja vedelik eraldub.(struktuur tugevneb aja jooksul)
On olemas ka anorgaanilisi geele- saviliistakute vhel
LÜOBOOBSETE DISPERSSETE SÜSTEEMIDE OMADUSED
Millest on tingitud lüofoobsete disperssete süsteemide agregatiivne püsivus? Millised protsessid võivad iseeneslikult kulgeda nendes süsteemides?
Lüofoobsed süsteemid on agregatiivselt püsivad ainult kineetiliselt (ehk nende agregeerumis võtab aega). Süsteemi saab veel stabiliseerida
Milliseid meetodeid kasutatakse lüofoobsete disperssete süsteemide valmistamisel? Tooge näiteid.
Mille poolt on määratud kondensatsioonitsentri raadius uue faasi tekkel? Kuidas saab reguleerida lüofoobsete disperssete süsteemide mõõtmeid kondensatsioonimeetodil?
Mida nimetatakse koagulatsiooniks? Millega lõpeb koagulatsiooniprotsess? Milliste võtetega saab esile kutsuda lüofoobse kolloidsüsteemi koagulatsiooni?
Protsess, mille käigus kolloidosakesed põrkudes liituvad ja viimaks settivad välja
Mida nimetatakse kiireks ja aeglaseks koagulatsiooniks? Milline on seos koagulatsioonikiiruse ja osakestevahelise toime potentsiaalse energia barjääri vahel?
Kiire – potentsiaalibarjääri pole, limiteerib ainult difusioon ja selle kiirus. Aeglase koagulatsiooni puhul on olemas ka potentsiaalibarjäär. Aeglase koagulatsioonikiirus = kiire koagulatsioonikiirus / potentsiaalibarjääri kõrgus.
Mille poolest erinevad aeglase ja kiire koagulatsiooni kiiruskonstandid? Millised dispersse süsteemi parameetrid mõjutavad koagulatsioonikiirust?
Mida nimetatakse kogulatsiooniläveks? Kuidas mõjutab koaguleeriva iooni laeng koagulatsiooniläve väärtust?
Vähim elektrolüüdi kontsentratsioon, mis kutsub esile koagulatsiooni. Mida suurem laeng, seda madalam k. lävi ja mida vähem solavateeritud, seda madalam koagulatsioonilävi
Milliseid aineid kasutatakse lüofoobsete disperssete süsteemide stabiliseerimisel?
Kasutatkse kõrgmolekulaarseid ühendeid (polümeere), mis adsorbeeruvad lüofoobse faasi pinnale ja stabiliseerivad seda. Samuti kasutatakse pindaktiivseid aineid.
Näidake osakestevahelise potentsiaalse energia kõvera abil dispersse süsteemi stabiilse eksisteerimise tingimusi. Mille poolest erineb osakestevaheline interaktsioon I-s ja II-s miinimumis?
Kuidas klassifitseeritakse emulsioone? Milliseid aineid kasutatakse emulsioonide stabiliseerimisel?
Emulsioon- selline dispersne süsteem, mis koosneb 2 teineteises mittelahustuvast vedelikust. Kusjuures 1 neist on väikeste tilgakestena teises.2 tüüpi- vesi-õlis (otsene emulsion) või õli-vees (kaudne emulsioon). Olemas on ka mitmikemulsioonid, kus dispersne faas sisaldab omakorda dispergeeritud tilgakesi. Emulsioonide stabliliseerimiseks kasutatakse PAA
Mida nimetatakse hüdrofiilseks-lipofiilseks tasakaaluks (HLT)? Mida iseloomustab HLT arv?
HLT ks nimetatakse suhet emulgaaturi suguluses veega ja selle suguluses õliga ehk number, mis iseloomustab, kummas faasis emulgaator meelsamini lahustub. Mida suurem on HLT arv, seda suurem on emulgaatori hüdrofiilsus
Kui PAA lahustub vees paremini (vrld õliga), siis moodustub õli-vees eulsioon, kui PAA lahustuvus on parem õlis, siis moodustub vesi-õlis-emulsioon.
Milles seisneb vahtude stabiliseerimise eripära? Milliseid aineid kasutatakse vahtude tekitamiseks?
Puhta vedeliku vaht pole püsiv, tuleb kasutada vahutekitajat. Head õ-v emulgaatorid on tavaliselt ka head vahutekitajad (Fairy )
Vahu stabiilsus sõltub:
Vedelikukile äravoolust
Vedelikukile rebenemisest juhuslike häirituste tõttu
(veel võib mõju avaldada aurustumine)
Milliseid süsteeme nimetatakse suspensioonideks? Milles seisneb suspensioonide stabiliseerimise eripära?
Suspensioon on dispersne süsteem, kus osakeste suurus on üle 1 mikromeetri. Saadakse peaaegu eranditult tahke aine dispergeerimisel vedelikus või pulbri-vedeliku segamisel. Ioonide või solvateeritud makromolekulide adsorptsioonitulemusel moodustub suspensiooniosakeste pinnale adsorptsiooniline kaitsekiht, mis annab küllaldase agregatiivse püsivuse.
Tooge näiteid suspensioonide, emulsioonide, vahtude ja aerosoolide praktilise kasutamise kohta.
Kosmeetikas, mullide valmistamine, vannivaht
