Eksamiküsimuste vastused aines Analüütiline keemia II
Lisamise aeg:
2015-08-14 11:36:16Vaatamiste arv:
14284Tagasiside:
1 0Analüütiline keemia II
Vastused eksamiküsimustele
Õppeaasta 2012/13 kevadsemester
Mitmesugused füüsikalised meetodid
Elektromagnetlainete skaala, piirkonnad, ühikud ja energia.
| Liik |
Lainepikkus |
Sagedus |
Footoni energia |
| Gamma, röntgen |
<10 nm |
>10*1018 Hz |
>124 eV |
| UV |
10-380 nm |
30*1015 -790*1012Hz |
3,3-124 eV |
| Vis |
380-700 nm |
790*1012 -430*1012Hz |
1,7-3,3 eV |
| IR |
700nm-1 mm |
430*1012 -300*109 Hz |
1,24 meV-1,7 eV |
| Mikro |
1mm-1 m |
300*109- 300*106 Hz |
1,24 mkeV-1,24 meV |
| Raadio |
1 mm-100 000km |
300*109- 3 Hz |
12,4 feV- 1,24 meV |
Energia elektronvoltides; 1eV=1,6*10-19 J; aatomite raadiused angströmites 1 Å= 0,1 nm
Si süsteemi eesliited: E (exa)1018 ; P (peta)1015; T(tera)1012; G (giga)109; p (pico) 10-12; f (fempto) 10-15
Elektromagnetlainete laine- (klassikaline) ja kvantkäsitlus.
Kiirgus kui elektromagnetlaine: elektri ja magnetväli on teineteise suhtes risti ja samas faasis; sellega kirjeldada lihtsam interferentsi, difraktsiooni, murdumist, hajumist.
Kvantkäsitlus: kiirgus on footonite voog; sobib hästi kiirgumise, neeldumise kirjeldamiseks, fotoelektriline efekt ka?
Mis on kiirguse interferents, difraktsioon, murdumine, hajumine?
Interferents: Interferents on füüsikaline nähtus, kus kahe (või mitme) ühesuguse lainepikkuse ja konstantse faasinihkega laine liitumisel tekib uus lainemuster. Selliseid laineid nimetatakse koherentseteks.
Difraktsioon: füüsikaline nähtus, mille korral laine paindub ümber väikeste takistuste või levib väikesest avast välja
Murdumine: laine levimissuuna muutus kahe keskkonna lahutuspiiril. Valguslaine murdub tingimusel, et keskkonnad on erineva optilise tihedusega ja valgus saab minna esimesest keskkonnast teise. Valgus murdub, kuna optiliselt mittehomogeensetes keskkondades valguse levimiskiirus muutub.
Hajumine: protsess, mille käigus kiirgus (valgus, heli, osakeste voog) kaldub kõrvale oma sirgjoonelisest liikumistrajektoorist liikumisteele jääva keskkonna tõttu, enne samasuunaliselt liikunud kiirgusosakesed peegelduvad objekti erinevatest punktidest tagasi erineva nurga all.
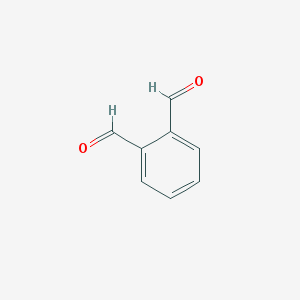
Joonistage instrumentaalanalüüsi seadme üldskeem koos selgitustega.
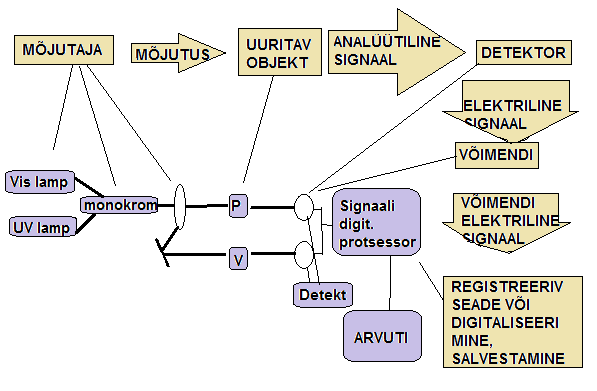
Analüütiline signaal, müra, signaal-müra suhe. Selgitage neid mõisteid ja illustreerige.
Analüütiline signaal on uuritavas objektis analüüdi poolt põhjustatud vastus välisele mõjutusele, mida saab mõõta. Annab kasulikku informatsiooni analüüdi kohta.
Müra annab kõrvalist informatsiooni ja on ebasoovitav. Müra on juhuslik ja väljendatav standardhälbena.
Signaal-müra suhe väljendab, mitu korda on analüütiline signaal intensiivsem kui müra. S/N; ühikuta, sisuliselt suhtelise standardhälbe pöördväärtus.
Müra liigid.
Jaguneb instrumentaalseks ja keemiliseks. Instrumentaalsed mürad pärinevad seadmest: kiirgusallikas, detektor, võimendi; tüübid:
termiline: tekib sellest, et laengukandjad on soojusliikumises, mis on juhuslik ja põhjustab laengujaotuse fluktuatsioone.
haavlimüra (shot noise): tekib, kui laengukandja ületab kahe keskkonna vahelise barjääri (pn siire, elektroni väljumine fotoelektronkordisti dünoodi pinnalt)
vilkemüra (flicker noise): pikaajalised triivi ilmingud elektroonikakomponentides; intensiivsus on pöördvõrdeline sagedusega (1/f) see müra muutub oluliseks sagedustel alla ca 100 Hz
foonmüra: üleüldine ümbrusest tulenev mürafoon; elektriliinid, raadiolained.
Keemilised mürad pärinevad mõõdetavast objektist:
temperatuuri fluktuatsioonid muudavad süsteemi omadusi
segavad ained (ebapiisav selektiivsus)
analüüdi osaline lagunemine
Molekulide elektronolekud, nende eluead, nende seosed erinevate spektroskoopiliste meetoditega.
Kiirguse neeldumise või kiirgumisega kaasneb aineosakeste (aatomid, molekulid) üleminek ainesiseste olekute vahel. Toimuda saavad vaid need üleminekud, mille korral energianivoode erinevus vastab neelduva või kiirguva kvandi energiale.
Paarisarvulise elektronide arvuga molekulide korral on võimalikud olekud:
singletne molekul: kõik elektronid on paardunud
tripletne molekul: on kaks paardumata elektroni
Lähteolekus on enamus molekule singletsed; tähistatakse s0; osakesed, millel on 1 paardumata elektron- radikaalid; dupletne molekul.
Singletse osakese ergastumisel läheb osake üldjuhul üle singletsesse ergastunud olekusse: singlett-singlett üleminek; seejuures enamasti mõnele vibratsiooniergastusnivoole. Vibratsiooniergastuste alamnivoode vahelised üleminekud on kiired (u 10-12s) ; elektronergastusnivoode vahelised üleminekud nii kiired pole (10-6...10-12s). Üleminekud saavad olla nii kiirgusega (fluorestsents) või kiirguseta (sisekonversioon). Vibratsioonilised ergastustasemed mängivad rolli Raman spektroskoopia ja IR spektroskoopia juures. Elektronergastusega tegeleb UV-Vis. IR ja UV-Vis relakseerumist ei vaadelda, see toimub enamasti sisekonversioonil. Fluorestsentsspektroskoopias ergastatakse molekul elektronergastusnivoole ja mõõdetakse relakseerumisel esinevat fluorestsentskiirgust. Aatomspektroskoopias tegeleb elektronergastuse tõttu neeldumisega AAS, Emissiooniga AES ja fluorestsentsiga AFS, aatomspetroskoopia meetodiks on ka XRF, milles kasutatakse röntgenkiirgust.
Selgitage laseri tööpõhimõtet.
Stimuleeritud kiirgumine: kui ergastatud osakesele mõjub kvant, siis naaseb osake põhiolekusse, kiirates kvandi, mis on koherentne ja samasuunaline pealelangeva kvandiga. Stimuleeritud kiirgumine toimub, kui kvandi energia on sama suur kui osakese ergastatud ja põhioleku energiate erinevus
Kiirguse neeldumine on stimuleeritud kiirgusega konkureeriv protsess. Neeldumise tulemusel viiakse osakesed (tagasi) ergastatud olekusse.
Kiirgus saab võimenduda, kui stimuleeritud kiirguse teke ületab kiirguse neeldumist. See on võimalik ainult juhul, kui ergastatud olekus on rohkem osakesi kui põhiolekus- PÖÖRDHÕIVE. Pöördhõive saavutatakse pumpamise abil.
Optiline aatomspektromeetria (AAS, AES, AFS)
Milliste (aatomi tasandil) nähtustega tegelevad optilise aatomspektromeetria meetodid? Selgitada skeemi abil.
Aatomspektroskoopia tegeleb aatomite väliskihi elektronide üleminekutega, mis vastavad UV-vis laineala elektromagnetlainete energiatele.) SKEEM
Energiatasemed sõltuvad konkreetsest aatomist- väliskihi elektronkonfiguratsioonist. (energiatasemete skeem). Mida madalama temperatuuriga on atomisaator, seda vähem jooni spektritesse ilmub. (Üleminekut ergastet olekust põhiolekusse või vastupidi nim resonatsüleminekuks.)
AES füüsikalised alused.
Toatemp on aatomid põhiolekus, termilisel ergastusel võib elektron üle minna kõrgemale energiatasemele. Kui elektron sealt jälle madalama energiaga tasemele liigub, võib ta kiirata footoni. Kiiratavate kvantide sagedused on igale aatomile iseloomulikud.
AAS füüsikalised alused.
Gaasifaasis aatomid võivad kiirgust neelata.
Miks on AAS spektrites vähem jooni kui AES spektrites?
AFS füüsikalised alused.
Aatom ergastatakse UV-Vis kiirguse abil. Madalamale energiatasemele liikudes vabaneb energiakvant, mis siis detektreeritakse ja on eri elementidele iseloomulik.
Mis on aatomspektroskoopias spektrijoonte laienemise põhjuseks? Mida nimetatakse spektrijoone loomulikuks laiuseks?
Spektrijoone laiuseks nim neeldumis- või kiirgumismaksimumi laiust poolel kõrgusel. Laienemist põhjustavad:
Heisenbergi määramatuse printsiip: laienemine 10-4 A suurusjärku; loomulik joonelaius
Doppleri efekt: põhjustatud kiirgava aatomi liikumisest detektori suunas või sellest eemale; suurendab loomulikku joonelaiust ca 2 suurusjärku.
Rõhk-põrked teiste osakestega: põhjustavad aatomi põhioleku energiataseme väikeseid muutusi. Sellest tingit joonelaius on 2-3 suurusjärku suurem kui loomulik laius.
(Elektri- ja magnetvälja efektid (Zeeman))
Selgitage Heisenbergi määramatuse printsiibi olemust!
Kui kahe oleku eluead läheneksid lõpmatusele, siis läheneks nendevahelisele üleminekule vastava piigi laius 0-le. Põhioleku eluiga lähenebki lõpmatusele (selle oleku energia on suhteliselt väikese määramatusega ) ja ergastatud olekute eluead on tavaliselt lühikesed, (umbes 10-7 sek) seega nende tasemete energia on suurema määramatusega. Ja kahe energiataseme erinevusele vastavav kvant võib omada sagedust selle määramatuse piires
määramatuse printsiip: delta (eluiga) * delta (sagedus) > 1
Selgitage Doppleri efekti olemust!
Doppleri efekt seisneb selles, et lainepikkuse muutus (lühema poole) on võrdeline laineallika kiirusega vaatleja suhtes.
Detekteeritav (kuuldav) sagedus on kõrgem (vrld kiiratava sagedusega) kui kiirgav objekt läheneb detektorile (kuuljale) ja madalam kui kiirgav objekt kaugeneb detektorist.
Mida kiiremini objektid liiguvad, seda suurem efekt.
Millist rolli mängib temperatuur aatomspektroskoopias? (Lisaks muule pidada silmas ka Boltzmanni jaotust, Doppleri efekti ja osakeste põrkeid.)
Temperatuuri mõju:
Reeglina mida kõrgem temperatuur, seda efektiivsem on atomisatsioon ja seda rohkem on leegis aatomeid
Mida kõrgem temp, seda suurem osa on ergastatud, kuid ergastatud olekus on ainult väike osa aatomitest, seda saab välja arvutada Boltzmanni jaotuse abil
Nj/N0=Pj/P0*exp(-E/kT); k=1,38*10-23 J/K; Nj ja N0- aatomite arv ergastatud ja põhiolekus. Pj ja P0- statistilised faktorid, mis on määratud võrdse energiaga olekute arvuga ergastatud ja põhiolekus, E- ergastatud ja põhioleku energiate erinevus.
Rõhk-põrked: mida kõrgem temperatuur, seda rohkem põrkeid ja seda rohkem toimub aatomite põhiolekutes väikseid muutusi.
Doppleri efekt: kõrgem temperatuur, seega suurem kiirus osakesel ja seega suurem Doppleri efekt.
Kuidas tekivad aatomspektroskoopia puhul riba- ja pidevspektrid?
Pidevspekter tekib tahkete osakeste hõõgumise kiirgusest (absoluutselt musta keha kiirgus). Ribaspektrid tekivad molekulaarsetest osakestest (oksiidid; CaOH)
Tahkete proovide sisestusmeetodid aatomspektroskoopias. (Vähemalt 2)
Eeliseks lahustamise vajaduse puudumine, kuid samas on tülikas teha kalibreerimiskehasid
asetamine otse atomisaatorisse (kaarlahendusega AES)
elektrotermiline aurusti sobib ka tahkete proovide jaoks
Kaar- või sädelahendusel tekkinud aatomid juhitakse inertgaasi vooluga atomisaatorisse
Laser-ablation- materjal aurustatakse proovi pinnalt laseri impulsi abil ja kantakse atomisaatorisse inertgaasi abil.
Vedelate proovide sisestusmeetodid aatomspektroskoopias. (Vähemalt 2)
Enamasti sisestatakse proove vesilahustena, harvemini mittevesilahuseid ja suspensioone; proovisisestus reprodutseeritavalt on tehniliselt keeruline ja vastutusrikas
pneumaatiline nebulisaator (kapillaaris vedelik, selle ümber kõrge rõhuga gaas, gaasi väljumissava ja kappillaari ots sama koha peal, gaas peksab kapillaari otsast vedelikku peenete tilkadena välja) tekitab aerosooli, mis viiakse gaasivooluga atomisaatorisse
ultrahelinebulisaator- proov pumbatakse piesoelektrilisele kristallile, mis võngub sagedusega üle 20 kHz- saadud aerosool on tihedam ja homogeensem
elektrotermiline aurusti- proov viiakse juhtivale pinnale, mida kuumutatakse elektrivoolu abil. Gaasivool viib atomisaatorisse, erinevalt eelnevatest saadakse signaali impulsid, mitte pidev signaal.
Millised on põhilised atomiseerimisviisid AAS analüüsil? Kirjeldage lühidalt nende tööpõhimõtet?
Leekatomisatsioon: Lahus pihustatakse (nebulisatsioon); tilgakesed aurustuvad väiksemateks (desolvatatsioon); aerosooliosakesed lenduvad; molekulid dissotsieeruvad; AATOMID; aatomid ioniseeruvad. Leegi eri osade temperatuur ja oksüdeerivad omadused on erinevad; leegi madalamas osas tekib suhteliselt vähe oksiide, kuid lühikese leegis viibimise aja tõttu on vabu aatomeid suhteliselt vähe. Leegi kõrgemas osas on aatomeid rohkem, kuid hakkavad tekkima oksiidid. Iga analüüdi jaoks on oma analüüsi jaoks parim piirkond leegis.
Elektrotermiline atomiseerimine:grafiittoru (mille sees võib olla proovi platvorm). Toru kuumutatakse elektrivoolu toimel (mõnisada amprit) 2000-30000C. Proov aurustub ja atomiseerub. Aatomid viibivad optilisel teel kuni 1s. ET atomisatsiooniga saavutatakse suured tundlikkused ka väga väikeste proovikoguste korral. Määramispiir u 10-10..10-13 g . Suhteliselt aeganõudvam, dünaamiline ala kitsas.
Külm aur: kasutatakse ainult elavhõbeda määramiseks. Hg oksüdeeritakse Hg2+, see redutseeritakse tagasi Hg-ks SnCl2 abil, õhuvoolu abil kantakse Hg aurud läbivooluküvetti.
Millistest etappidest koosneb atomiseerimine leek-AAS puhul?
Lahus pihustatakse (nebulisatsioon); tilgakesed aurustuvad väiksemateks (desolvatatsioon); aerosooliosakesed lenduvad; molekulid dissotsieeruvad; AATOMID; aatomid ioniseeruvad.
Võrrelge leekatomisatsiooni ja elektrotermilist atomisatsiooni! (Võrrelda täpsust, määramispiiri, dünaamilist (lineaarset) ala, proovi kasutamise efektiivsust, tehnilist teostust (keerukus, analüüsi aeg, aatomi viibimise aeg), saadavat signaali)
Leekatomisatsioon on reeglina täpsem 1% või parem, samal ajal kui ET on 5-10%. Samuti on ET meetodid aeganõudvamad, ühe elemendi määramiseks kulub mitu minutit ning neg küljeks ET on ka kitsas dünaamiline (lineaarne) ala. Leekatomisatsioonil on küll kõrgemad avastamispiirid ja seega kasutataksegi ET enamasti, kui on madal avastamispiir on tähtis (ja proovikogused väiksed)
ET puhul viibib aatom kauem aega optilisel teel, ET on tehnilise teostuse poolest keerulisem, sest proovi sisestamine reprodutseeritavalt on keeruline. Proovi kasutamise efektiivsuse suhtes on ET parem- kulub vähem proovi.
Selgitage külma auruna atomiseerimise põhimõtet!
Kasutatakse ainult elavhõbeda määramiseks. Hg oksüdeeritakse Hg2+, see redutseeritakse tagasi Hg-ks SnCl2 abil, õhuvoolu abil kantakse Hg aurud läbivooluküvetti.
AAS instrumendi põhimõtteskeem.
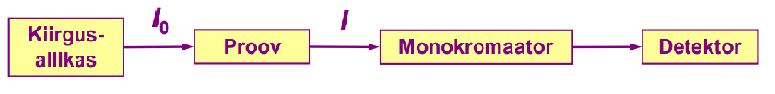 Kiirgusallikaks on lamp, milles kiirgav element on sama kui see, mida tahetakse määrata. Proov peab olema atomiseeritud. Monokromaator pärast proovi, sest proov ka kiirgab (leek).
Kiirgusallikaks on lamp, milles kiirgav element on sama kui see, mida tahetakse määrata. Proov peab olema atomiseeritud. Monokromaator pärast proovi, sest proov ka kiirgab (leek).
AAS kiirgusallikas: nõuded, ehitus, tööpõhimõte.
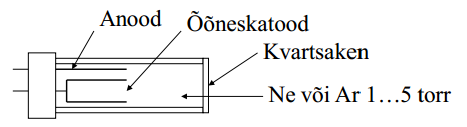 Aatomite neelamisjooned on väga kitsad (0,002...0,005 nm). Selleks, et neeldumine oleks kirjeldatav Beeri seadusega, peaks kiirgusallika lainepikkuste vahemik olema kitsam kui aatomite neeldumisjooned. Kitsa vahemiku saamiseks kasutatakse lampe, mis sisaldavad määratavat elementi.
Aatomite neelamisjooned on väga kitsad (0,002...0,005 nm). Selleks, et neeldumine oleks kirjeldatav Beeri seadusega, peaks kiirgusallika lainepikkuste vahemik olema kitsam kui aatomite neeldumisjooned. Kitsa vahemiku saamiseks kasutatakse lampe, mis sisaldavad määratavat elementi.
Õõneskatoodlamp- kõige tavalisem AAS kiirgusallikas. Katood kaetakse uuritava elemendiga, pinge ca 300 V juures inertgaas ioniseerub. Inertgaasi katioonid löövad katoodi pinnalt välja metalli aatomeid. Osa väljalöödud aatomeid on ergastatud olekus, seega kiirgavad. Aatomid sadestuvad tagasi katoodile (või klaasile). Lambi efektiivsus sõltub geomeetriast ja lambi tööparameetritest. Kõrge pot elektroodide vahel (st suurem vool) suurendab kiiratavat intensiivsust, kuid Doppleri efekti tõttu suureneb emissioonijoonte laius ja suureneb ka ergastumata aatomite hulk lambis (?) See toob kaasa omaneelamise. Seega hoitakse tööparameetrid sellised, et lambi töötemp oleks madalam atomisaatori omast.
Segavad mõjud AAS analüüsil.
Kõige suurema mõjuga on keemilised segavad mõjud: mittetäielik atomiseerimine (GF), ioonid, lenduvad soolad (GF), karbiidid (GF), kondensatsioon; maatriksist põhjustatud tausta neeldumine; oksiidide ja molekulaarioonide moodustumine (F) Vähelenduvaid ühendeid on halb analüüsida. Spektraalseks segavaks mõjuks, et (F) leek ise kiirgab, (mõlem) teised osakesed võivad neelata, kiirata, hajutada (GF) proovi täpset asukohta tuubis pole teada, proovi sisestamine;
Lineaarne ala väike, maatriksi segavate mõjude tõttu kasutatakse tihti lisamismeetodit.
Milline on suurimat määramatust põhjustav etapp AAS analüüsil?
Kõige suuremat määramatust põhjustav etapp on proovi ettevalmistamine;sest enamasti tahetakse proovi lahuse kujul; ka mineraalid, taimsed, loomsed proovid tuleb lahustada.
Lahustamise ekstreemsed tingimused võivad põhjustada analüüdi kadu (tilkadena aurus, anuma seintele). Samuti võivad lahustamiseks kasutatavad ained sisaldada määratavaid komponente (viimane eriti oluline jälgede määramisel)
(tahke puhul pole proovisisestamise tehnikad hästi korratavad ja standardite valmistamine tülikas)
AAS lineaarne ala ja määramispiir.
Neeldumine peaks teoreetiliselt alluma Beeri seadusele, kuid praktikas see nii sageli pole. Seega on vaja kalibratsiooni lineaarsus tõestada ja seda kontrollida.
Lineaarne ala tüüpiliselt 2..3 suurusjärku, tüüpilised määramispiirid: leek 1..20 ng/ml; ET 0,002...0,01 ng/ml
Moduleerimisel ja pidevkiirguse allikal baseeruv taustakorrektsioon AAS spektroskoopias. Selgitada tööpõhimõte ja visandada skeemid.
Kui atomisaatoriks on leek, siis leek ise kiirgab, analüüt osaliselt ergastub ja kiirgab.
Selleks, et kiirgusfooni mõõdetud intensiivsusest maha lahutada katkestatakse perioodiliselt pealelangev kiirgusvoog (meh katkesti, lambi kustutamine). Korrigeeritud signaaliks on Ilambiga-Ilambita. Ühekiireline instrument ei korrigeeri allika ebaühtlust, neeldumist, hajumist leegis.
Pidevkiirguse allikaga saab võrrelda
Kahe joone meetod ja kahekiireline spektromeeter taustakorrektsiooniks AAS spektroskoopias. Selgitada tööpõhimõte ja visandada skeemid.
Kahe joone meetod: valitakse lambi kiirgusspektrist mõni joon, mis on analüütilise lainepikkuse lähedal, kuid selline, mida analüüt ei neela (mõne teise elemendi joon lambist)
Eeldatakse, et kõik hajumised ja neeldumised mõjutavad võrdselt analüütilise ja võrdluskiire intensiivsust. (Sobivat võrdlusjoont sageli pole)- võetakse arvesse analüütilise joone ja võrdlusjoone intensiivsuste suhte sõltuvust kontsentratsioonist.
Kahekiireline instrument: leegi kiirgus võetakse arvesse, lambi ebaühtlus samuti, kuna võrdluskiir ei läbi leeki ei võeta arvesse neeldumist/hajumist leegis.
AFS instrumendi põhimõtteskeem.
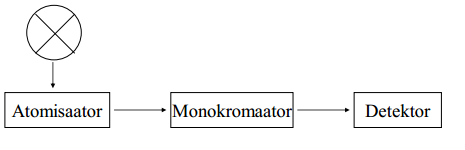
AES instrumendi põhimõtteskeem ja liigid.
 Liigid:
Liigid:
leek
säde-kaarlahendus
ICP
Mis on plasma? Kuidas tekitatakse induktiivselt seotud plasma?
Plasma on elektrit juhtiv gaasiline segu, mis sisaldab märkimisväärsel hulgal elektrone ja katioone. Plasma summaarne laeng on ligikaudu 0. AES-s kasutatakse tihti argooniga plasmat, milles tekkivatele argooni ioonidele antakse välise elektromagnetväljaga piisavalt energiat, et säilitada plasmaolek. Plasma temperatuurid küünivad 10 000 K ligi.
Induktsioonivool on raadiosageduslik (ca 30 Mhz), võimsusega kuni 2 kW. Kui ajas vahelduv elektrivool läbib spiraalikujulist elektroodi, tekitab ta ajas muutuva magnetvälja oma ümber, mis indutseerib spiraali suhtes risti elektrivoolu väärisgaasis ja lõpuks moodustub plasma.
Kuidas viiakse proov plasmasse?
Kõige tavalisem proovisisestusviis on pneumaatilise nebulisaatori abil; proovisisestuseks kasutatakse veel ka ultrahelinebulisaatorit, elektrotermilist aurustit. Saadud gaas juhitakse argoonivoolu abil plasmasse
Võrrelge leeki ja plasmat atomisaatorina!
Plasmas ei teki ioone, oksiide eriti. Temperatuur on ühtlasem; mõlemad kiirgavad ise ka. Tahmaosakesi samuti plasmas olla ei tohiks. Plasma tulemused on paremini korratavad, lineaarne ala suurem.
Atomisatisoon täielikum ja keemilisi segavaid mõjusid vähem plasma korral. Omaneeldumine on plasma puhul väike, sest temperatuur on ühtlane.
Milliste elementide määramiseks ICP-AES sobib ja millistele mitte? Põhjendage!
Sobib pm kõigi elementide määramiseks.
Suhteliselt kehvad määramispiirid on ainult aktiivsemate leelismetallide puhul, sest nende kõige intensiivsemad kiirgamisjooned asuvad lähis-IR alas ja selleks oleks vaja teistsugust detektorit (et saada paremaid määramispiire). Sarnane probleem on halogeenide ja N,O,S, mille tarvis oleks vaja vaakum-UV ala detektorit
Kaar- ja sädelahenduse AES. Põhimõte ja kasutusala.
Kasutatakse kvalitatiivses ja pool-kvalitatiivses analüüsis. Proovid on enamasti tahked. Kaarlahenduse korral esineb proov 1 elektroodina või asetatakse proovi tükikesed grafiitelektroodi süvendisse. Teiseks elektroodiks grafiitelektrood. Kasutatakse fotograafilise registreerimisega ja paljude fotoelektronkordistitega mitmekanalisi instrumente, põhiliselt metallurgias kasutatakse
Kaarlahendus: tekib elektrivoolu toimel (kuni 30 A) Elektroodide vahel tekib plasma, mille temperatuur on ligi 5000 K. Emissoonispektrites on palju jooni, ioonidele vastavaid jooni vähe. Kuna kaarlahendus on suhteliselt ebapüsiv ja analüüdid aurustuvad elektroodi pinnalt eri aegadel, siis on vaja signaal keskmistada. Alati kasutatakse sisestandardit, kuna spekter sõltub palju proovi maatriksist.
Sädelahendus: elektrivoolu toimel (ca 1000 A) Elektrivool kandub ühelt elektroodilt teisele kitsa „kanali“ kaudu, mille temperatuur hinnatakse 40000K kõrge temp tõttu on ioonide emissioonijooni küllalt palju. Kvantitatiivseks analüüsiks peab täpselt kontrollima analüüsitingimusi, sh proovi koostis ja kuju, kasutatakse sisestandardmeetodit.
Milliste elementide määramiseks kasutatakse leek-AES? Miks ainult nende elementide jaoks?
Kasutatakse leelismetallide (vahel ka Ca) määramiseks, leegi temp on piisav leelismetallide ergastamiseks, kuid ei ergasta muid (segavaid) metalle. Spektrid on lihtsad ja nii on võimalik kasutada lihtsaid seadmeid (valgusfiltrid, nähtava spektriala detektorid)
Paljud AAS seadmed võimaldavad leegiga AES teha. Tavalisim rakendus on Na, K määramine bioloogilistes vedelikes (vereplasma, uriin)
LIBS (laser-induced breakdown spectroscopy) põhimõte ja omadused.
AES alaliik; laserkiir juhitakse materjali pinnale, pinnalt aurustub ca nanogramm materjali, aurustumise hetkel moodustub väga kõrge temperatuuriga plasma,kõrgetel temperatuuridel aine dissotsieerub ergastatud ioonideks ja aatomiteks. Sel ajal kiirgab plasma pidevspektrit, millest analüüsis kasu pole. Siis väga lühikese aja jooksul plasma paisub ja sellega koos jahtub. Siis saab detekteerida aatomite karakteristlikke emissioonijooni. Seega „jahtunud“ aatomite kiirgusspektreid registreeritakse.
Avastamispiirid on enamasti 10 ppm suurusjärgus
Kasutab väga vähe proovi, peaaegu mittedestruktiivne,võimalus proovi kaardistada ja ka distantsilt analüüsida, on kaasaskantav. Puuduseks see, et kuna laseri energia varieerub on korratavus vilets.
UV-Vis spektromeetria
Reastage spektri värvused lainepikkuste kahanemise järjekorras! Lisage ligikaudsed lainepikkused!
Punane 650-750
Oranž 595-650
Kollane 560-595
Roheline 490-560
Sinine 435-490
Violetne 400-435
Kui aine või lahus on värvitu, siis millest see tuleb? (Ehk, et milliseid järeldusi selle aine kohta võib teha?)
Kui aine või lahus on värvitu, siis see ei neela ühtki nähtava valguse piirkonna lainepikkust (400-750 nm). Tõenäoliselt ei ole tegu siirdemetalli kompleksiga.
Kui vedelik või lahus on läbivas valguses sinise värvusega, siis millest see tuleb?
Neelab oranži (kõige tõenäolisem)
Võib neelata kõiki muid värve ja lasta läbi sinist
Emiteerida sinist fluorestsentsi kaudu
Millistes ühikutes mõõdetakse optilist neelduvust? Läbilaskvust?
Neelduvusel otsest ühikut pole (A=log(I/I, ühikud taanduvad suhtes välja), tihti kirjutatakse numbrite taha küll AU ehk absorption unit. Läbilaskvusel samuti ühikut pole, küll aga väljendatakse läbilaskvust tihti protsendi kaudu.
Millistest kaalutlustest lähtudes valitakse lainepikkus UV-Vis spektroskoopilistes määramistes?
Võimalikult pika lainepikkusega võimalikult intensiivne maksimum.
Milliseid (lisa)võimalusi annab optiliste kiudude (fiiberoptika) kasutamine UV-Vis analüüsil?
Saab kuivboksis oleva aine spektrit mõõta (ei pea masinat ennast kuivboksi panema.)
Saab otse reaktsioonisegus on-line neelduvust mõõta
Milliseid dispergeerivaid elemente kasutatakse UV-Vis spektrialas ja kuidas neid kasutatakse monokromaatorites?
Dispergeeriv: eraldab lainepikkused UV-Vis spektrialas kasutatakse prismat difraktsioonivõret, (interferentsfiltrit)
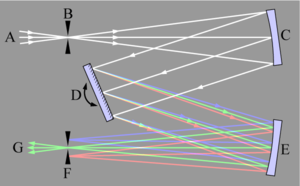 Monokromaatoris kasutatakse dispergeeriva elemendina põhiliselt difraktsioonivõre, kaug-UV alaks sobib paremini prisma, niisiis see võib ka olla. Monokromaator töötab põhimõttel, et dispergeeriva elemendi peale suunatakse valgusviht, disp element lahutab selle kitsasteks lainepikkuste vahemikeks. Soovitav lainepikkuste vahemik lastakse väljundpilust edasi minna. Siis disp elementi pööratakse mingi teatud nurga võrra ning järgmine lainepikkuste vahemik pääseb pilust läbi.
Monokromaatoris kasutatakse dispergeeriva elemendina põhiliselt difraktsioonivõre, kaug-UV alaks sobib paremini prisma, niisiis see võib ka olla. Monokromaator töötab põhimõttel, et dispergeeriva elemendi peale suunatakse valgusviht, disp element lahutab selle kitsasteks lainepikkuste vahemikeks. Soovitav lainepikkuste vahemik lastakse väljundpilust edasi minna. Siis disp elementi pööratakse mingi teatud nurga võrra ning järgmine lainepikkuste vahemik pääseb pilust läbi.
Monokromaator peaks olema enne proovi, et mitte proovi soojendada- temperatuuri efekt; ja vältida uv valguse lagundavat mõju org molekulidele.
Milliseid filtreid kasutatakse monokromaatse UV-Vis kiirguse saamiseks?
Klaasfilter
Orgaaniline aine kahe klaasplaadi vahel, selline org aine, mis laseb läbi ainult 1 lainepikkuste vahemikku,
interferentsfilter
Interferentsfiltri tööpõhimõte.
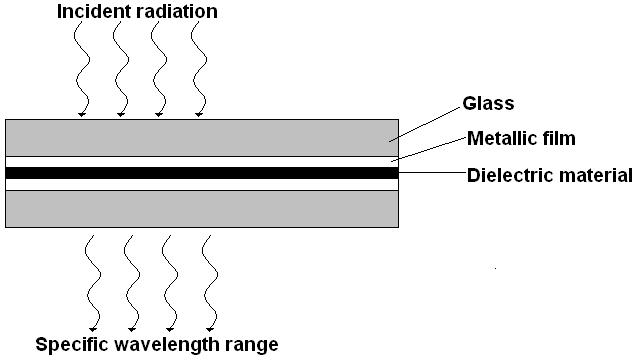 Nagu nimi viitab, põhinevad interferentsfiltrid interferentsil. See koosneb kahest õhukesest poolläbipaistvast metallkihist, mille vahel läbipaistev dielektrik (CaF2). See kõik on pakitud klaasplaatide vahele. Kui kiir langeb filtrile siis esialgu läbib klaasi, siis osa läbib, osa peegeldub metallikihil. See osa, mis läbib metallikihti omakorda kas läbib või peegeldub metallikihilt. Peegelduv kiirgus, kui see on sobiva lainepikkusega, interfereerub konstruktiivselt sissetuleva sama lainepikkusega kiirgusega. Ehk sobiv lainepikkus võimendub (kindla paksusega) dielektriku kihi sees. Ülejäänud lainepikkused interfereeruvad destruktiivselt.
Nagu nimi viitab, põhinevad interferentsfiltrid interferentsil. See koosneb kahest õhukesest poolläbipaistvast metallkihist, mille vahel läbipaistev dielektrik (CaF2). See kõik on pakitud klaasplaatide vahele. Kui kiir langeb filtrile siis esialgu läbib klaasi, siis osa läbib, osa peegeldub metallikihil. See osa, mis läbib metallikihti omakorda kas läbib või peegeldub metallikihilt. Peegelduv kiirgus, kui see on sobiva lainepikkusega, interfereerub konstruktiivselt sissetuleva sama lainepikkusega kiirgusega. Ehk sobiv lainepikkus võimendub (kindla paksusega) dielektriku kihi sees. Ülejäänud lainepikkused interfereeruvad destruktiivselt.
Kuidas mõjutab UV-Vis spektromeetri pilulaius saadavaid spektreid? Kuidas valitakse optimaalne pilulaius?
Mida kitsamad pilud, seda rohkem detaile spektris, kuid liiga kitsa pilu korral jääb valguse intensiivsus liiga väikeseks ja spektris on ka rohkem müra.
Optimaalse pilulaiuse saamisekss võetakse esialgu suur pilulaius ning vähendatakse seda järjest kuni pilu laiuse vähendamine enam spektrit ei muuda. Tavaline pilu laius u 10% neeldumismaksimumi laiusest poolel kõrgusel.
Kitsama pilu korral saadakse UV-Vis spektrisse rohkem detaile. Miks siis ei kasutata ülikitsaid pilulaiusi?
Suur lahutusvõime oleks hea, aga siis oleks signaali intesiivsus väiksem, detektor peaks olema tundlikum ja müra oleks rohkem.
Milliseid kiirgusallikaid kasutatakse UV-Vis spektromeetrites?
Deuteerium (ja vesinik)lambid: UV -alas pidevspekter
Wolfram hõõglambi:kõige tavalisem Vis ja NIR allikas, kiirgab sarnaselt absoluutselt mustale kehale ja seega sõltub selle kiiratav spekter suuresti temperatuurist. (Seetõttu on voolutugevuse stabiilsus väga tähtis. Wolfram-halogeenlambid, ehk joodilisandiga wolframlambid on pikema elueaga, sest I reag gaasilise W => WI2, mis kuuma volframtraadiga kokku põrgates uuesti laguneb.
Ksenoon-kaarlambid: annab intensiivset kiirgust (W-lambist intensiivsem), vool läbi Xe atmosfääri, pidevspekter vahemikus umbes 250 kuni 600 nm, kõige intensiivsem 500 nm juures
Selgitage deuteeriumlambi tööpõhimõtet! Millise laineala kiirgust see annab?
Pidevspektrit UV-alas annab elektriliselt ergastatud D2 .
Alguses ergastub D2 elektrienergia toimel olekusse D2* ja see laguneb D' +D'' + hυ .
Summaarse protsessi energiat väljendab võrrand: Ee = ED2* = ED ' + ED ' ' + hυ.
ED2* on fikseeritud hulk energiat, samal ajal kui ED ' ja ED ' ' on kahe deuteeriumiaatomi kineetilised energiad. ED ' + ED ' ' väärtus võib varieeruda pidevalt nullist kuni ED2* . Niisamuti saab varieeruda ka hυ energia.
UV-Vis detektorid.
Fototoru: 150-1000 nm: poolsilindriline katood ja peenike (juhe) anood. Katoodi sisepind kaetud materjaliga, mis eraldab elektroni kui sellele kiirgus peale langeb. Elektroodide vahele tekitatakse pinge ja kuna torus on vaakum, siis voolutugevus vooluringis on võrdeline katoodile langenud kiirgusega. (Torul on UV-vis alas läbipaistvad aken (kvarts nt ?)
Fotoelektronkordisti:150 -1000 nm. Pealelangev kiirgus vabastab jällegi elektrone, mis kiirendatakse kõrgema pos potents elektroodile- dünood , seal löövad olemasolevad elektronid veel elektrone välja jne.
Fotodiood: Si pooljuht, 350-1100 nm: Fotodiood on ehitatud nii, et tema pn-siire oleks keskkonnast langevale valgusele avatud. pn-siirdele langevad footonid, tekitavad vabade laengukandjate paare (augud ja elektronid), mis siirde elektrivälja toimel pn-siirde läbivad. Tekkiv voolutugevus on proportsionaalne pealelangenud kiirgusele. On tundlikumad kui fototorud, kuid vähem tundlikud kui fotoelektronkordistid.
Dioodrivi: palju dioode kõrvuti; võimaldab spektreid mõõta väga kiiresti; aparatuuri ehitus veidi teistsugune, nimelt disp element on pärast proovi koos dioodriviga
Milliseid eeliseid annab dioodrividetektor võrreldes ühekanalilisega?
On võimalik praktiliselt silmapilkselt kogu spekter mööta; sobib rakendustesse, kus kiirus on tähtis- näiteks reaktsioonisegu uurimiseks.
Võrrelge ühe- ja kahekiirelist UV-Vis spektromeetrit! (Lisage skeemid.)
JOONISTA SKEEMID ÕPIKUST!
Kahekiireline eemaldab kiirgusallika ebaühtlusest tekkiva vea.
Milliste protsessidega on seotud kiirguse neeldumine UV-Vis spektrialas?
Üleminekutega küllastumata ühendites; Pii-piitärn n-piitärn üleminekutega, d ja f -elektronide üleminekutega B-metallides (1. ja 2. üleminekumetallide rida: 3d ja 4d elektronid), lantanoidid, aktinoidid 4f ja 5 f elektronid
Selgitage mõisted sininihe (hüpsokroomne nihe) ja punanihe (batokroomne nihe)!
Sininihe: solvendi polaarsuse suurenedes nihkub n-piitärn neeldumine tavaliselt lühemate lainepikkuste poole (polaarne solvent hoiab elektrone endale, ja n-elektronide energia tuuakse allapoole; pii-elektronide energia väheneb vähem; n ja pii elektronide energia erinevus suureneb vrld mitte pol lahustiga seega neeldumise energia suureneb, sinise poole)
Punanihe: pii-piitärn: pii elektronide energia kahanemine vähene; piitärn kahaneb ka, aga veidi rohkem, sest tegu on rohkem polariseeritava orbitaaliga; energiate vahe muutub väiksemaks, energia väiksem, lainepikkus suurem, seega punase poole)
(HERE's A FUN FACT: Kromofoor: molekuli osa, mis vastutab värvuse eest, neelab või interakteerub valgusega
pii-piitärn üleminekute epsilon on tunduvalt suurem (u 10-100 korda) kui n-piitärn üleminek. See-eest on neeldumismaksimum n-piitärn üleminekute korral pikema lainepikkusega kui pii-piitärn.)
Kuidas mõjutab solvent UV-Vis spektreid? (Vihjed: spektraalsed omadused, lahustuvus, polaarsus, pH, tasakaalud)
Mittepolaarsetes kk saadud spektrid sarnanevad rohkem gaasifaasi spektritele
Polaarsed solvendid kipuvad spektrite peenstruktuuri kinni katma, „silendavad“ spektreid, toime sarnane sellele, kui kasutada suuremat pilulaiust
Solvent peab lahustama uuritavat ainet, sest lahused peavad olema selged
Solvent ei tohi analüüdiga reageerida
Proovi ja st lahuste jaoks tuleb kasutada sama solventi, sest solvent mõjutab ka neeldumismaksimimide asukohti
Kui on tegu happeliste/aluseliste omadustega ainega, siis pH peaks olema mõõtmiste käigus konstantne, (absorptsioonispekter sõltub pH-st)
tasakaalud???
Lahusti:peaks olema läbipaistev võimalikult suures piirkonnas;
Kuidas sõltub läbilaskvus neelava osakese kontsentratsioonist? Visandage graafik!
TULETA
Beeri reegel. (Seosed A, T, a, b, c, P, ε vahel). Beeri reegel ainete segude korral. Beeri reegli kehtivuspiirid (piirangud).
P- kiirguse võimsus; korrektsem oleks kasutada P kui I; A la =alabc ; molaarne neeldumistegur sõltub lainepikkusest väga palju; molekuli omadustest, sõltub ph-st (happe-aluse indikaatorid); sõltub veidi ka temperatuurist ja ioontugevusest. EI SÕLTU KONTSENTRATSIOONIST (esimeses lähenduses).
Beeri reegel segude kohta: segu neelduvus on summa komponentide neelduvustest. Sellel reeglil on piirid:
tõelised, füüsikalised piirangud
kehtib lahjades lahustes kõrgematel hakkavad molekulid üksteise laengujaotust mõjutama, neelamisvõime muutub. Epsilon kõrgetel konts sõltub konts.
Lahustunud aine võib muuta lahuse murdumisnäitajat ja seeläbi jõuab det vähem valgust ja Beeri reegel ei kehti.
Keemilised piirangud:
kui neelav osake lahuses muutub, reageerib, dissots vms
instrumentaalsed piirangud: pole ideaalselt monokromaatne kiirgus; kui spektraalne pilulaius 2 nm, siis annab vahemiku 2nm ulatuses. Peab võtma maksimumi lainepikkuse; II probleem: hajuskiirgus; kui lahus neelab ära kogu antud lainepikkuse; kiirgus, mis det jõuab peaks olema 0; aga on ikka natuke, sest kuskilt peegeldunud, hajunud kiirgus jõuab ikka detektorisse, põhjustab väiksemaid neeldumisi kui oleks teoreetiliselt
Milliseid küvette kasutatakse UV-Vis spektroskoopias?
UV-alas proovi küvett kvartsist
Vis alas kvartsist, klaasist, plastist
Võrrelge filtriga ja monokromaatoriga UV-Vis instrumente!
Filtriga instrumendi puhul ei saa määrata kogu spektrit, saab teada ainult neelduvuse mingis lainepikkuste vahemikus. Filtreid peab erinevate ainete jaoks vahetama.
Filtriga masin on vähem kapriisne, lihtsama analüüsi jaoks sobib hästi, signaal-müra suhe hea. Monokromaatoriga masin kallim, saab mõõta kogu spektrit, kapriissem, signaalmüra suhe kehvem, ei pea vahetama filtreid (ilmselgelt). Parem keerukamate analüüside jaoks.
Millised üleminekud on UV-Vis spektroskoopias kõige kasutatavamad? Miks?
Pii-piitärn ja n-piitärn üleminekud, sest sigma-sigmatärn ja n-sigmatärn üleminekud asuvad vaakum-UV alas, kus mõõta on ebamugav, sest ka õhu koostisosad neelavad vaakum-UV alas. Kõige kasutatavamad, kuna sisalduvad org molekulides ja neid on kõige sagedamini vaja analüüsida. Ka siirdematallide d-f üleminekud on uv-vis alas on olemas; lantanoidid, aktinoidid omavad erilisi UV-vis neeldumisi- neeldumismaksimumid kitsad, teravad vrld org molekulidega; ei lähe sassi teistega ning ka laenguülekandega kompleksid on väga kasulikud, sest nende molaarsed neeldumistegurid on väga suured.
Mis tüüpi ühendeid on UV-Vis spektroskoopia abil kõige parem uurida?
Kõige parem on uurida laenguülekandega komplekse, kuna neil on väga suured molaarsed neeldumised ning see teeb analüüsi nendega väga tundlikuks. Samuti on väga hea uurida lantanoide- aktinoide kuna neil on väga iseloomulikud kitsaste maksimumidega spektrid.
Laenguülekandega neeldumine.
Analüüsi seisukohalt ühed huvipakkuvamad, epsilonid suured ja seega on analüüsi tundlikkus ka väga suur. Nt raua iooni (2+/3+) kompleksid: tiotsüonaadiga, tiotsüonaadi vaba elektron läheb neeldumise käigus üle raua vabale orbitalile. Nagu teiste ergastustegagi, naaseb elektron pärast lühiajalist ergastust taas oma esialgsele kohale.
UV-Vis spektrid kvalitatiivses ja kvantitatiivses analüüsis.
Kasutatakse lihtsas kvantitatiivseks analüüsiks Beeri seaduse abil. Madalate c-de juures kehtib lineaarsus väga hästi, üldiselt on UV-Vis spektroskoopia meetodi lineaarne ala üsna kitsas: töötada saab A-de vahemikus 0,02
Kasutatakse kvantitatiivseks analüüsiks väga palju kuna..
saab analüüsida väga palju erinevaid aineid, nii orgaanilisi kui ka anorgaanilisi
suhteliselt hea tundlikkus (10-4 kuni 10-5)
keskmine kuni hea selektiivsus
hea täpsus (tavaliselt 1-3 % määramatust)
kasutamise lihtsus ja mugavus
Kvalitatiivselt ainete tuvastamine on piiratud, kuna neeldumismaksimumid pole väga spetsiifilised.
Kasutatakse väga laialt - nõrkade hapete-aluste tasakaalukonstantide, jaotuskoefitsentide, kiiruskonstantide määramine; kompleksimoodustamise uurimisel, kolorimeetrilises tiitrimises ja kromatograafias detektrorina.
Fotomeetriline tiitrimine, selle eelised võrreldes otsese fotomeetriaga.
Kasutatakse tiitrimise ekvivalentsuspunkti määramiseks kui analüüt, reaktiiv või tiitrimise produkt neelab kiirgust.
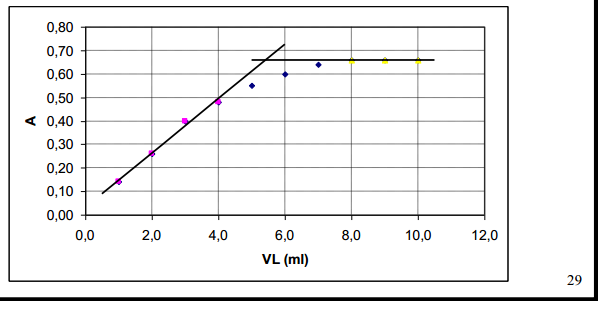 Kui alguses 1 ml, siis lisat titranti- lahuse c väheneb seega kasutatakse konts parandamiseks (tekkiv osake justkui viiakse algsesse lahusesse) c*(V+v)/V Kui produkt neelab, siis alguses neeldumine lineaarselt kasvab, pärast jääb platoole, kui enam juurde ei teki; y-teljega pole midagi teha va see, et näha, millal toimub muut kasvust platoole- see on suur pluss, sest maatriksi neelduvus ei mõjuta. A+T =P (Analüüt+titrant=produkt) epsA=0, epsT=0 epsp>0 siis on taoline graafik.
Kui alguses 1 ml, siis lisat titranti- lahuse c väheneb seega kasutatakse konts parandamiseks (tekkiv osake justkui viiakse algsesse lahusesse) c*(V+v)/V Kui produkt neelab, siis alguses neeldumine lineaarselt kasvab, pärast jääb platoole, kui enam juurde ei teki; y-teljega pole midagi teha va see, et näha, millal toimub muut kasvust platoole- see on suur pluss, sest maatriksi neelduvus ei mõjuta. A+T =P (Analüüt+titrant=produkt) epsA=0, epsT=0 epsp>0 siis on taoline graafik.
Nefelomeetria ja turbidimeetria.
Nefelomeetria: kui on tegu suspensiooniga (lahuses tahked osakesed) siis saab mõõta hajunud kiirgust; mõõtmine viiakse läbi pealelangeva kiirguse suhtes nurga all.
Turbidimeetria: kiirgusallikas, monokrom, filter, proov, otsesuunas detektor: mõõdetakse hajumist;(intensiivsuse vähenemist suspensiooni läbimisel) saab läbi viia ka uv-vis spektromeetriaga; nt valkude määramiseks; sadestatakse sellisel moel, et tekib suspensioon ja suspensiooni tihedust teades, saab teada, palju valku oli.
Fluorestsentsispektroskoopia
Fluorestsentsi mõiste. Ergastumine, relaksatsioon, erinevad relaksatsiooniprotsessid.
Fluorestsents: kiirgusega üleminek olekusse S0 vn ja sealt edasi kiirguseta üleminek olekusse S
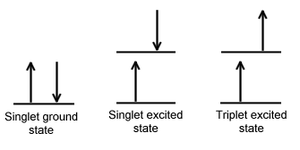 Ergastumine: Singletsete osakeste ergastumisel läheb osake üldjuhul üle singletsesse ergastusolekusse, seejuures enamasti mõnele vibratsiooniergastuse nivoole.
Ergastumine: Singletsete osakeste ergastumisel läheb osake üldjuhul üle singletsesse ergastusolekusse, seejuures enamasti mõnele vibratsiooniergastuse nivoole.
Relaksatsioon: väga kiiresti toimub võnkerelaksatsioon (kõrgematelt võnkeergastustasemetelt madalamale); aeglasemalt toimub sisekonversioon ehk kõrgemalt elektronergastusnivoolt madalamale elektronergastusnivoole üleminek. Nii sisekonversioon kui ka võnkerelaksatsioon on kiirguseta protsessid ja energia muundub soojuseks.
Elektronergastusnivoolt relakseerumiseks on 4 võimalust:
sisekonversioon
fluorestsents: kiirgusega üleminek,
väliskonversioon- põrkub, annab temp võnkumist teisele molekulile
Intersüsteemne üleminek, singletsest tripletsesse, spinn muutub, aeglane protsess ja sp haruldane, siis tekiks fosforestsents
Ergastus- ja emissioonispektrid fluorestsentsis, nende omadused.
Fluorestsentsis mõõdetakse alati fluorestsentskiirguse intensiivsust; muuta saab nii pealelangevat kui ka tulevat kiirgust ja sellest tulenevalt on kahte sorti spektreid: Ergastusspekter: muudetakse ergastuse lainepikkust, mõõdetakse saadud fluorestsentsi intensiivsust teatud konst lainepikkusel; näitab, kuidas ergastav lainepikkus mõjutab saadavat kiirgust; ergastusspekter on välja venitatud lühema lainepikkuse poole.
Emissioonispekter: Mõõdetakse fluorestsentsi intensiivsust erinevatel lainepikkustel hoides ergastuslainepikkust konstantsena; emissioonispekter on välja venitatud pikema lainepikkuse poole.
Ergastusspekter on lühemal lainepikkusel kui kiirgusspekter Stokes'i reegli pärast. Spektrijooned on laiad ja suhteliselt mittekarakteristlikud; küll aga on identifitseerimine parem kui UV-vis spektroskoopias, sest fluorestseerumine ise on harv.
Ei pea tingimata ergastama ergastusspektri maksimumi lainepikkusega, ei pea olema väga monokromaatne kiirgus, ergastatakse Uv-vis kiirgusega, peab olema küllalt intensiivne. Lainepikkuse muudetavus on enamasti oluline. Vanemates masinates on ergastuse lainepikkus fikseeritud.
Kiirgusallikad fluorestsentsi ergastamiseks, nende omadused, eelised-puudused.
Ergastamiseks kasutatakse UV kiirgust või nähtavat valgust. (Ergastusenergia on elektroonse ergastuse suurusjärgus. Ergastav kiirgus peab olema piisavalt intensiivne ja lainepikkuse muutmise võimalus on enamasti oluline (kui pole mingi konkreetse aine mõõtmiseks masin).
Allikad:
Ksenoon-kaar-lamp; pidevallikas (ca 150-800 nm): annab kogu soovitud vahemikus intensiivset pidevat kiirgust. Sobib hästi spektrofluoromeetritesse.
Elavhõbe-kaar-lamp; nii pidev osa kui ka jooned; filtritega eraldatakse vajalik välja.
Kasutada saab nii pidevkiirgust kui karakteristlikku; viimane intensiivsem ning sp kasutatakse peamiselt seda. Kuna ergastus ei pea tingimata olema fluorestsentsi maksimumile vastava lainepikkusega, siis tavaliselt vähemalt üks elavhõbeda karakteristlikest joontest sobib. Seega kasutatakse enamasti filterfluorimeetrites. (Pidevkiirgajana on vähem intensiivne kui ksenoon-kaar lamp)
Laser; veel tavaspektromeetrites vähe levinud, sest muudetava lainepikkusega laserid on kallid; väga levinud erirakendustes; võiks kasutada intensiivsuse pärast
Millistele tingimustele peab vastama aine molekuli struktuur, et aine fluorestseeriks? Tooge näiteid!
Molekul peab olema jäik: mittekiirguslik relaksatsioon põhineb võnkumisel, mida vähem on molekulil võimalik võnkuda, seda suurema tõenäosusega toimub kiirguslik relaksatsioon; väga paljud metallikompleksid on jäigad; metallikomplekside fluorestsentsi kasutatakse metallide määramiseks
molekulis elektrodonoorsed rühmad; mida rohkem on on donoorseid rühmi, mida vähem aktseptoorseid, seda kõrgem on fluorestsentsi tõenäosus.
Selleks, et saaks ergastuda peab omama ka intensiivseid neeldumisi UV või vis alas; selliste omadustega eeskätt, pii-süsteemid, metallikompleksid
Derivatiseerimine fluorestsentsil. Põhimõte, näide. Miks on derivatiseerimine fluorestsentsispektroskoopias väga levinud, UV-Vis spektroskoopias aga mitte?
 Vähesed ained fluorestseeruvad, selle parandamiseks analüüte derivatiseeritakse
Vähesed ained fluorestseeruvad, selle parandamiseks analüüte derivatiseeritakse
ehk analüüdi molekul viiakse mõne sobiva reagendi abil vormi, mis fluorestseerub. Näide: OPA- orto ftaalaldehüüd: muundab aminohapped fluorestseerivateks indoolderivaatideks; on aminohapete analüüsil üks tähtsamaid reagente.
Derivatiseerimine fluorestsentsspektroskoopias väga levinud,
sest vähesed ained fluorestseeruvad. UV-vis puhul pole probleem
nii suur- suhteliselt paljudel ainetel on neeldumismaksimume
UV- vis alas.
Fluorestsentsispektromeetrid, nende ehituse põhimõtted.
Tava-kasutuses on levinumad 2 aparaadi konstruktsiooni 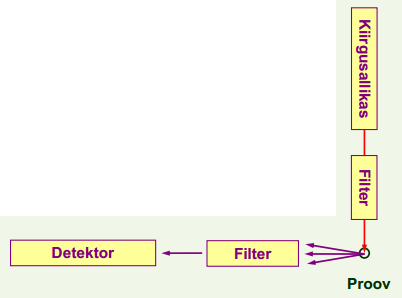 :
:
Filter-fluoromeetrid:
kaks filtrit: ergastavast kiirgusest filtreeritakse välja sobiv lainevahemik; fluorestsentskiirgusest filtreeritakse ka välja vajalik vahemik.
Saab mõõta lihtsalt teatud ergastustingimustega fluorestsentsi intensiivsust, vastab umbes filter-fotomeetrile.
Pildil aparatuuri üks võimalik ühekiireline skeem
Spektrofluoromeetrid
Kaks monokromaatorit; üks ergastava kiirguse jaoks, teine fluorestsentskiirguse
jaoks. Sellega saab registreerida spektreid. Pildil kahekiireline spektrofluoromeeter:
Kõrgetasemelisemad:
laserfluorestsents-süsteeemid
mikroskoopia/imaging
Fluorestsentsispektroskoopia eelised ja puudused.
Eelised:
madalad avastamispiirid ehk sobib jälgede määramiseks.
Lai lineaarne ala florestsentsi intensiivsuse ja analüüdi konts vahel. (kvant analüüs tavaliselt tavalisel kal. graafiku meetodil)
miniaturiseeritav (HPLC detektorina)
vajadusel on väga kõrge selektiivsus saavutatav
Puudused
Rakendusala kohati piiratud
kohati kapriisne
(PAH polütuumne aromaatne süsivesinik)
IR Spektroskoopia
Infrapunane kiirgus. Milliste arvkarakteristikutega saab infrapunast kiirgust iseloomustada? Millist elektromagnetkiirguse lainepikkuste vahemikku nimetatakse infrapunaseks kiirguseks?
Infrapunane kiirgus on elektromagnetiline kiirgus, milles lainepikkused on pikemad kui nähtaval valgusel. Kohe pärast punast valgust algab lähisinfrapunase ala- 1000..2500 nm ehk 10 000 .. 4000 cm-1- IR kiirguseala on 4000...400 cm-1 ; lainepikkused 2500.. 25 000 nm. Footoni energia on 1.24 meV kuni 1.7 eV
Mis toimub infrapunase kiirguse neeldumisel aines?
Neeldumise käigus suureneb molekulide tuumade omavaheliste võnkumiste amplituud.
Neeldumised spektris vastavad molekulide üleminekutele madalamalt võnkenivoolt kõrgematele võnkenivoodele ehk toimub võnkumise ergastumine.
Molekulil on teatav hulk iseloomulikke võnkumisi, millele vastavad need võnkenivood
Rangelt võttes toimub molekuli ergastumisel kogu molekuli võnkumise kasv, kuid interpreteerimisel arvestatakse, nagu hakkaks ühe fun rühma piirdes rohkem võnkuma. Ehk paljusid võnkumisi saab siduda konkreetsete funktsionaalrühmadega.
Aine infrapunane spekter. Mille poolt on määratud konkreetses aines neelduva infrapunase kiirguse sagedused? Tooge näiteid.
Konkreetses aines neelduvad IR kiirguse sagedused on määratud:
massi järgi: mida raskemad aatomid võnguvad seda väiksem lainearv ja seega madalama energiaga neeldumine.
sideme jõukonstandi järgi (jäikuse näitaja): mida jäigem side (kolmikside vs üksikside), seda suurem lainearv (kõrgema energiaga neeldumine)
Võnkumised on tavaliselt baasvõnkumised, veel on ülemtoonid ja kombineeritud võnkumised
(kui erinevad võnkumised hõlmavad sama fragmenti molekulid, siis nad kombineeruvad
Milline on infrapunase kiirguse neeldumise tingimus?
Selleks, et molekuli mingi võnkumine saaks ergastuda IR kiirguse toimel, peab selle võnkumise käigus muutuma molekuli dipoolmoment. (Sest kui võnkumise käigus muutub dipoolmoment, siis muutub perioodiliselt ka elektriväli ?ja seega saab see side interakteeruda elektromagnetlainetega) Mida suurem dipoolmoment, seda intensiivsem on neeldumine. Enamasti kehtib, et mida polaarsem rühm, seda intensiivsem spektrijoon. Sideme dipoolmoment pole range suurus, sõltub pikkusest ja laengute jaotusest
Infrapunase kiirguse allikad. Nende võrdlus.
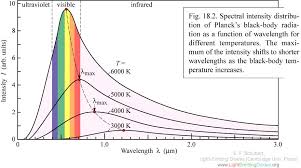 Infrapunane kiirgus on soojuskiirgus, seega on kiirgusallikateks erinevad kuumad kehad. Väga tähtis kiirgusallika juures on püsiv temperatuur.
Infrapunane kiirgus on soojuskiirgus, seega on kiirgusallikateks erinevad kuumad kehad. Väga tähtis kiirgusallika juures on püsiv temperatuur.
Musta keha kiirgus (kõige puhtamal kujul temperatuuri mõjul kiirgaja, midagi ei jäta endale, kõike kiirgab ära?)- nähtavas osas kiirguse intensiivsus suur, IR alas väike ja temp tõstmine ka ei aita.
Nernsti varras; ZrO2- Y2O3 -ThO2 segust kokku pressitud varras, kuumutatakse elektrivooluga, töötemp 1900 ºC; kuna takistus alaneb temp tõustes, siis vajab toitevoolu kontrolli, et läbi ei põleks. parim NIR jaoks
Globar: ränikarbiidist varras, kuumutatakse jällegi elektrivooluga; töötemperatuur 1200-1400 ºC; parem kesk-IR jaoks; vajab jahutamist
hõõguvkuum traat (praktikumi masinas)- nikroom; traat oksüdeerub lõpuks, põleb läbi, tema elu jooksul muutub tema poolt kiiratav energia ja ka tema kuju
odavaim, madal energia, väiksem intensiivsus.
Ülevaade Infrapunases spektroskoopias kasutatavatest materjalidest. Materjalide omaduste võrdlus. Millised on kõige levinumad materjalid? Miks?
Pole universaalset head kiirgust läbi laskvat materjali (klaas ja kvarts on piiratud kasutusalaga)
KBr-levinum, nõuab kuivatit, sellest tehakse nii spektromeetrite detaile kui ka proovide aknaid (kõik vajab kuivatust), levinud, sest odav ja suhteliselt suures alas läbipaistev; sel on üks laiemaid läbipaistvuspiirkondi IR-alas kõigist seal kasutusel olevatest materjalidest
CsI- kallis, hügroskoopne, aga saab mina alla 400 cm, kõige laiem kasutuspiirkund Kasutatakse kallimates masinates, pehme ka ja raske on teha aknaid
KRS-5, kallis, hea, vett ei karda, koosneb TlBr ja TlI; kõvem kui NaCl, Kcl, KBr
Ge- kallis, kuid hea, vett ei karda, kõrgeima murdumisnäitaja
IR Kvarts- väga hea, kui saab piirduda alaga ülalpool 2500 cm-1
väga hea kõva materjal- teemant
Lahustiteks
lahustite valik on piiratud- enam-vähem sobivad kloreeritud süsivesinikud: CCl4, C2Cl2, mitmesugused freoonid. Enamasti kehtib lahustite puhul, et molekulis ei tohiks olla H-aatomit. Pole sellist lahustit, mis oleks kogu kesk-IR alas läbipaistev.
Ülevaade IR spektroskoopias kasutatavatest põhilistest detektoritest. Nende eelised ja puudused üksteise suhtes.
IR kvantide energia on madal, sellepärast ei saa hästi kasutada fotoelektrilisi detektoriteid. IR detektoreid on põhiliselt 4 tüüpi:
termilised- näiteks väike absoluutselt must keha, mõõdetakse temp tõusu, vähetundlik, kk mõju tuleb elimineerida; teine variant on termopaar
pneumaatilised/fotoakustilised
püroelektrilised- elektrivälja äravõtmise järel on püroelektriline materjal endiselt polariseerutud ja see polarisatsioon sõltub temperatuurist- asetades sellise materjali kihi 2 elektroodi vahele (millest 1 on IR-le läbipaistev), saab temperatuurist sõltuva kondensaatori, ehk kondensaatori, mis temp impulsside mõjul annab elektriimpulssi.
DTGS- deuteeritud triglütsiinsulfaat): kiiretoimeline, lainearvude vahemik lai(12000 – 350 cm-1) , tundlikkus üsna kehv, küllalt odav
fotojuhtivusel põhinevad: pooljuht on asetatud mittejuhtivale alusele, IR kiirgus lööb mittejuhtivaid valentselektrone juhtivustsooni, seega on juhtivus sõltuvuses pealelangeva kiirguse energiast
Pliisulfiid- NIR
Hg-Cd-Te (MCT) kesk IR ala; küllaltki kõrge tundlikkusega, kiire reaktsiooniajaga, vajab jahutamist LN2 ,lainearvude vahemik kitsam (11 000 -600(400) cm-1), kallis, kasutusel kallimates masinates ja keerukamates rakendustes (IR mikrospektroskoopia jne)
Jahutada on vaja, sest toatemperatuuril on juba mõnede osakeste soojusenergia piisav, et toimuks elektronide üleminek.
Võrrelge DTGS ja MCT detektorit IR spektroskoopias.
DTGS on laiema lainearvude vahemikuga, kuid kehva tundlikkusega, MCD mõnevõrra kitsama lainearvude vahemikuga, kuid küllaltki kõrge tundlikkusega. MCD on kallim ja vajab jahutamist vedela lämmastikuga, DTGS on odavam. MCT on kiire reaktsiooniajaga.
Fourier' teisendusega IR spektromeetri tööpõhimõte.
Kõigi lainepikkuste läbi skanneerimise asemel registreeritakse kiirguse võngete profiil ehk signaali muutumine ajas. Kiirguse võngete profiil tekitatakse Michelsoni inferomeetriga.
Tulemuseks saadakse nn time-domain ehk interferogramm, millele rakendatakse Fourier teisendus ja saadakse nn frequency domain spekter, mis ongi sisuliselt normaalne spekter.
Fourier'teisendusega IR spektromeetri põhilised eelised skaneeriva IR spektromeetriga võrreldes.
EELISED
Parem signaal-müra suhe, sest kasutab ära kogu kiirguse (IR allikad on nõrgad ja detektorid madala tundlikkusega, vajavad palju kvante signaali registreerimiseks)
Registreerib väga kiiresti spektreid, saab koguda ja keskmistada-> signaal müra suhe veel paremaks.
Lainepikkuste skaala on väga täpselt paigas, see on eelduseks keskmistamisel ja mitmesugustel mahalahutamisoperatsioonidel. ( laser kontrollib peegli asendit)
praktiliselt puudub hajuskiirguse probleem
lahutusvõime sama üle kogu skaala, spektrites puuduvad katkestused;
Pole enam oluliselt kallim
Detektor pea ka olema kiirem;
masinad on ühekiirelised; seega taust tuleb enne registreerida, siis kui tausta ja proovi mõõtmine eri aegadel peab garanteerima keskkonna konstantsuse (co2 sisalduse vähenemine kohe spektrist näha kui aken lahti tehtud vahepeal.)
MILLEST TULEB SIIN LAHUTUSVÕIME?
Milliseid võnkumisi nimetatakse valentsvõnkumisteks? Milliseid võnkumisi nimetatakse deformatsioonvõnkumisteks?
Valentsvõnkumisteks nim võnkumisi, kus muutub sideme pikkus, (sümmeetrilised, asümmeetrilised) deformatsioonvõnkumisteks nim võnkumisi, kus muutuv sidemete vaheline nurk.(tasandilised, ruumilised)
Tooge näiteid sidemetest, mille valentsvõnkumistele vastavad intensiivsed IR spektrijooned. Tooge näiteid sidemetest, mille valentsvõnkumistele vastavad nõrgad IR spektrijooned. Selgitage, miks see nii on!
INTENSIIVSED:
C=O sidemele vastab intensiivne spektrijoon, kuna polaarsus muutub võnkumise käigus
O-H Vesiniksidemete tõttu ilmub laia intensiivse piigina
C- Cl
NÕRGAD:
C=C nõrgad IR spektri jooned, sest sideme polaarsus muutub vähe
C-H ka nõrgad, kuid summaarne piik tuleb tavaliselt suur, kuna neid sidemeid on lihtsalt väga palju.
(Imaging- saab spektri proovi eri osadest, mitte proovist kui tervikust)
Raman spektroskoopia
Raman-efekt. Raman-spektroskoopia põhimõte. Raman spektri tekketingimus.
Raman efekt- toimub mitte-elastne hajumine. (Umbes 1 hajunud kvant 10 000 000 hajunud kvandi kohta)
See tähendab, et kvandi sagedus on erinev pealelangenud kvandi sagedusest
enamasti on hajunud kvandi sagedus ning energia madalam.
Raman hajumise intensiivsus on väga madal.
Raman spekter on vibratsioonispekter ja piigid tekivad selliste sidemete kohta, mille võnkumise käigus muutub polariseeritavus.
Raman spektroskoopia võrdlus IR spektroskoopiaga.
IR- kvant neeldub, Ramanis liigub kvant edasi (kuigi väiksema (kõrgema) energiaga).
(Neeldumise-kiirgumisena pole kohane vaadelda, sest selle protsessi karakteristlik aeg oleks pikem, umbes 2 kuni 6 suurusjärku pikem.)
Ramanis kasutatakse enamasti nähtava kiirguse kvante, IR infrapunast.
Ramanis võib energia erinevus salvestuda vibratsioonilise, rotatsioonilise või elektroonse energiana, kuid enamasti tegeletakse vibratsioonilisega. IR- ainult vibratsiooniline. Lahustite suhtes ja „akende“ materjalide suhtes on Raman vähem nõudlik kui IR, Ramanile sobib vesi, klaas
Raman- aparaadid on kallimad
Vibratsiooninivood on samad, mis IR spektroskoopias, seega joonte asukohad on Ramanis ja IR samad.
Ramani X-teljel pole mitte kiirguskvanti iseloomustav abs suurus, vaid 2 kvandi energiate erinevus
Sageli on joon, mis on IR spektris nõrk, Raman spektris tugev ja vastupidi, sümmeetrilistes molekulides on see seaduspärasus vahel täiesti range nt CO2 korral.
Millist infot annab aine kohta Raman spekter?
Infona saadakse vibratsioonispekter (nähtavas alas); vibratsiooninivood on samad, mis IR spektroskoopias (sp joonte asukohad samad)
Raman spektrisse ilmuvad jooned, mis vastavad võnkumistele, mille käigus muutub molekuli polariseeritavus, siis neelab intensiivselt (selle kohta öeldakse, et on Raman spektris aktiivsed)
(Probleem fluorestsentsiga)
Aine infrapunaste ja Raman spektrite võrdlus. Tooge näiteid.
Ramanis intensiivsus väiksem
Raman spektri x teljel laineenergiate erinevus, lainearvude vahe.
Raman- kõige intensiivsemad jooned annavad sellised võnkumised, mille käigus polariseeritavus muutub polariseeritavus (C=O nõrk väike piik, C=C intensiivne piik)
IR- kõige intensiivsemaid jooned annavad võnkumised, mille käigus muutub polaarsus (pikaks venitatud side on polaarsem)
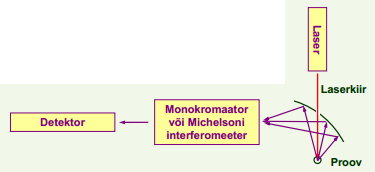 Raman spektromeetri põhimõtteskeem.
Raman spektromeetri põhimõtteskeem.
Kiirgust kogutakse enamasti pealelangemissuuna lähedalt, sest selles suunas on fluorestsents nõrgim
Võrrelge nõudeid kiirgusallikale Raman- ja infrapunases spektroskoopias.
Raman- intensiivne, monokromaatne, ergastamiseks kasutatakse nähtavat valgust või NIR; (ergastusenergia on elektroonse ergastuse suurusjärgus) Ergastav kiirgus peab olema nii monokromaatne kui võimalik, piisavalt intensiivne, lainepikkuse muutmise võimalus pole oluline.
IR-spektroskoopias on nõue, et kiirgaks IR alas pidevalt, pm soojuskiirgust pidevalt, Head intensiivset allikat pole.
Võrrelge nõudeid kiirgusallikale Raman- ja fluorestsentsispektroskoopias.
Fluorestsentsi puhul kasutatakse UV kiirgustvõi nähtavat valgust, Ramani puhul nähtavat ja lähisinfrapunast.
Mõlemal on nõue, et kiirgusallikas oleks intensiivne.
Fluorestsentsi puhul on enamasti ka tähtis lainepikkuse muutmise võimalus, ehk kiirgusallikas võiks anda pidevspektri. Ramani puhul pole lainepikkuse muutmine oluline.
Üldiselt sobib Raman kiirgusallikas- laser Vis alas- ka enamiku fluorestsentsspektroskoopia analüütide ergastamiseks ja kuna fluorestsents on väga, väga palju intensiivsem kui Raman-efekt, siis fluorestsents Raman spektroskoopias segav.
Röntgenmeetodid
Röntgenkiirgus. Millist elektromagnetkiirguse vahemikku nimetatakse röntgenkiirguseks? Milliste arvkarakteristikutega röntgenkiirgust saab iseloomustada?
Lainepikkused põhimõtteliselt 10-5...100Å; praktikas kasutatakse enim 0,1...25Å ehk 124..0,5 keV; λ=12,398/E (12,398=hc).
Kiirgus on kõrge energiaga, neeldub eeskätt raskemate aatomitega ainetes (kergemaid läbistab) Kiirgus on võimeline ioniseerima. Kiirguse lainepikkus on samas suurusjärgus aatomitevaheliste kaugusega ainetes.
Iseloomustage röntgenkiirguse ja aine vastasmõju. Millised on võimalikud protsessid aine kiiritamisel röntgenkiirtega?
Röntgenkiirgus on võimeline ainet ioniseerima, sellest elektrone välja lööma. Iseloomusta röntgenkiirguse ja aine vastasmõju Võimalikud protsessid on:
hajumine: selle mõju tavaliselt väike ja võib arvestamata jätta kui tegu on raskemate, mitte kergemate aatomitega
difraktsioon: aatomitasanditelt kui tegu kristalse ainega
neeldumine :raskemates elementides, al Na, lööb sisekihi elektroni välja
emissioon
läbimine: kui tegu kergemate elementidega
Millised on põhilised röntgenkiirte saamise meetodid? Millised neist on rohkem ja millised vähem levinud?
Metallobjekti pommitamine kõrge energiaga elektronidega
röntgenkiiretoru
skaneeriv elektronmikroskoop
ainele primaarse röntgenkiirte kimbu suunamine ja sekundaarse kimbu saamine fluorestsentsi teel
radioaktiivse allika abil
sünkrotroni abil (väga kallis, kuid väga kõrge intensiivsus ja monokromaatsus)
Levinumad: röntgenkiiretoru
Röntgenkiiretoru ehitus ja tööpõhimõte.
Elektrone kiirendatakse pingega U (mõnikümmend kilovolti, nt 50 kV). Kõrge energiaga elektronide metallobjekti pommitamisel tekib paralleelselt kahte tüüpi kiirgust:
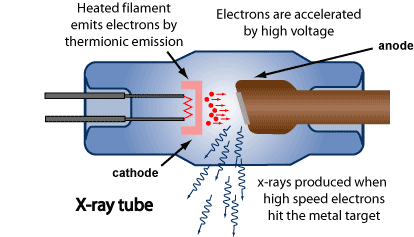 pärsskiirgus: elektroni järsust pidurdumisest; pole kvanditud; profiil on maksimumiga, esineb teatud min lainepikkus
pärsskiirgus: elektroni järsust pidurdumisest; pole kvanditud; profiil on maksimumiga, esineb teatud min lainepikkus
karakteristlik kiirgus: elektron ioniseerib aatomi ja tekkinud iooni relaksatsioonil eraldub kiirgus; on kvanditud. (K-seeria)
Vaakumis(KAS ÜLEJÄÄNUD MASIN KA?), sest teatud lainepikkustest alates X-kiirgus neeldub õhus
Anood on metallist (volfram, molübdeen, vask), katood on hõõguv volframfilament; nii kiirenduspinge kui ka filamendi kuumutus peavad olema hoolikalt stabiliseeritud, „Aken“ on berülliumist, toru kasutegur alla 1%
Selgitage röntgendifraktsioonanalüüsi (XRD) põhimõtet!
Meetod põhineb röntgenkiirguse difraktsioonil, difraktsioon toimub aatomtasanditelt, et meetod saaks toimida on vajalik korrapära, saab uurida vaid kristallilisi aineid.
Kiirgus on monokromaatne; kristallis saab leida palju erinevate vahekaugustega tasandeid (tasandite vahekaugused mõne Å suurusjärgus). Igale tasandile vastab difraktsioonimaksimum, mida rohkem difr max, seda keerukama ehitusega kristall
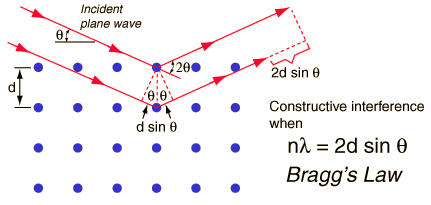 Röntgenkiirgus peegeldub kristallilt ainult kui nurk teeta rahuldab Braggi seadust, vastasel korral toimub destruktiivne interferents.
Röntgenkiirgus peegeldub kristallilt ainult kui nurk teeta rahuldab Braggi seadust, vastasel korral toimub destruktiivne interferents.
Milliste omadustega ainete kohta XRD annab informatsiooni ja milliste kohta mitte?
Kristalliliste ainete kohta, lahuseid, amorfseid aineid analüüsida ei saa. Tulemuseks saab kätte kristallvõre parameetrid. Kristalliline aine võib masinas olla nii pulbri kui ka monokristallina, viimane täpsem (erinevad masinad)
Pulbri-versiooni kasutatakse põhiliselt ainete identifitseerimiseks, mitte eriti struktuuri määramiseks. Monokristallist saab tunduvalt paremad difraktogrammid, võimalik struktuuri määramine, probleem: vaja saada ainest monokristall.
Selgitage lühidalt XRF meetodi põhimõtet.
Röntgenkiirguse neeldumisel tekivad ergastatud ioonid; elektronid lahkuvad sisekihtidest (k, L). Need ioonid siirduvad põhiolekusse sel teel, et mõni kõrgema kihi elektron langeb vabale kohale sisekihis. Vabanev energia eraldub kiirguskvandina: fluorestsents,
Proovi ettevalmistust pole vaja, levinuim meetod selleks- sulandamine Li-tetraboraadis (et vältida suurusest, kujust tingit efekte) väävli määramine kütuses.
WD: Juhitakse röntgenkiiretorust proovile kiirgust, proov emiteerib iseloomulike lainepikkustega kvante, see kiir juhitakse kristallile, mis toimib monokromaatorina. Kiiretorus kasutatakse pärsskiirgust (pidev), karakteristlik söelutakse välja. (peab kasutama kristalli, sest x-kiirgus saab läbida prisma, võre;
Millised elemendid on määratavad XRF meetodiga?
Praktiliselt kõik, va H ja Li; (II perioodi elemente erivõtetega) võib juhtuda, et kergemaid elemente hinnatakse üle (raskematest tulevad kvandid ergastavad kergemaid ja need omakorda kiirgavad; seega jääb mulje, nagu kergemaid elemente oleks rohkem).
Ideaalne juht on see, kui saab täpselt sama maatriksiga kalibreerida.
Milliste kihtide elektronid on tegevad XRF analüüsi juures?
Sisekihtide elektronid- K, L, M
NMR ja ESR spektroskoopia
Kuidas tekib signaal TMR spektroskoopias (selgitus spinnide pretsesseerimisega).
Tugeva magneti abil tekitatakse energiate erinevus tuuma eri spinnide vahel. Lühikeste raadiosageduslike impulssidega (mis on eri tuumadele iseloomulikud) ergastatakse tuumad ja viiakse tuumade pretsessioonid faasi ja siis registreeritakse magnetvälja (mis tekib tuumade koos liikumisest ning relakseerumisest) muutumist ajas. Lõpuks tuumad hakkavad ikkagi erinevalt pretsesseeruma, ps signaali intensiivsus lõpuks kahaneb.
Mõõdetakse välise tugeva magnetväljaga samas suunas relakseerumise tulemusel toimuvat magnetvälja muutust ajas
Millised on levinumad mõõdetavad tuumad TMR spektroskoopias?
Meetod on kasutatav ainult siis, kui tuumas on neutronite arv + prootonite arv paaritu number, 1H, 13C, 15N, 19F, 31P
Mis on TMR keemiline nihe ja kuidas on see seotud aatomituuma varjestatusega ning keemilise ümbrusega?
Keemiline nihe- Sagedused sõltuvad kasutatud magneti tugevusest, kui teljel on sageduse asemel kasutatud keemilist nihet, siis see enam ei sõltu kasutatud magnetist. Keemiline nihe saadakse valemi δ = 106 (υ - υs)/ υs kus υs on referentssagedus; väljendab uuritava tuuma signaali sageduse suhtelist erinevust miljondikes osades standardtuuma signaali sagedusest.
Varjestatus: toimub elektronide tiirlemise tulemusel, kuna suunatud laetud osakeste liikumine tekitab magnetvälja, tekkiv magnetväli võib olla tuuma jaoks välist magnetvälja nõrgestava toimega aga võib ka tugevdada.
Keemiline ümbrus: mida elektroneg on naaberaatom, seda väiksem on elektronide poolt tekitatav varjestatus uuritavale aatomile ja seda suurem on keemiline nihe.
Aatomi läheduses leiduvates 2sidemetes või 3sidemetes osalevad pii-elektronid võivad tekitada välise magnetvälja mõjul ringvoolu, mis omakorda tekitab magnetvälja. Tekkiv magnetväli suurendab keem nihet
Vesiniku aatomite signaalide multipletsus (lõhenemine). Millest see on tingitud ja millist infot annab?
See on tingitud sellest, et naaberaatomitega seotud vesinikud võivad olla magnetväljas samasuunaliselt või vastassuunaliselt orienteeritud. (Kui samasuunaliselt, tugevdavad üksteise signaale, kui vastassuunaliselt, siis nõrgendavad) Vastav jaotus on statistiline ja tekitabki signaali lõhenemise. 1 vesinik lõhestab 2-ks, 2 vesinikku 3-ks.
Annab infot, mitu vesinikku (või ka muud lõhestavat tuuma) läheduses.
Vesinike keemiline nihe ühendites, sealhulgas mõned näited tüüpilistest keemiliste nihete vahemikest.
Mida suurem nihe, seda vähem varjestatud (elektronid varjestavad, aromaatne tuum annab sama efekti, mis elektroneg aatomid, kuna aromaatne tugevdab välist magnetvälja)
Küllastatud alkaanide H keemilised nihked tüüpiliselt 0,2-0,8-ni, etüüni lõpu H keemiline nihe 0,8 kuni 1,8; aldehüüdide H :9,4 -9,8 (Kõik CDCl3 suhtes)
EPR (ESR) meetodi põhimõte ja rakendused
On NMR-ga analoogne meetod. Tegeleb paardumata elektronidega. Mõõdetakse paardumata elektronide poolt tekitatavat ajas kustuvat signaali, mis tuleneb elektroni üleminekust ühest spinnolekust teise.
Objektideks on vabad radikaalid, siirdemet ühendid, dopeeritud materjalid (materjalid, milllele on lisatud väga väike kogus muud ainet, et esialgse omagusi muuta, pooljuhtide jmt korral kasutatakse), defektidega kristallid. Rakendusala on väga spetsiifliline, sest radikaalid pole enamasti püsivad ja neid palju ei leidu.
Iga paardumata elektron 1 spektrijoon, mida omakorda lõhestavad teised paardumata elektronid (kui neid on) ja ka aatomituuma spinnid. Seetõttu näevad spektrid välja sarnased TMR spektritele.
Lõhestamispildi järgi saab teada, mis rühmad radikaali ümbruses asuvad.
Massispektromeetria
Massispektromeetria põhimõte.
ETAPID:
Gaasifaasiliste ioonide genereerimine ja nende kiirendamine elektriväljas
Ioonide eraldamine nende massi-laengu suhte alusel elektri- ja/või magnetväljas.
Kindla massi-laengu suhtega ioonide detekteerimine seadmega, mis on võimaline registreerima selleni jõudnud osakeste arvu.
Tulemus- massispekter
Massi ja laengu ühikud massispektromeetrias.
Laengu ühik -1,6*10-19 C; elementaarlaeng
Massi ühik 1,665*10-27 kg, 1/12*12C isotoop
praegune aatommassiühiku tähistus- u; kunagi au, amu, enam mitte.
Kasutatakse ka Daltonit, füüsikaliselt on nad identsed. Keskmisest molekulmassist rääkides kasutatakse tavaliselt Daltonit (biokeemia)
reeglina x-teljel massi-laegu suhe (ühikut pole); y-teljel intensiivsus, mõnikord „counts“- viimane on põhjendatud kui detektor on piisavalt tundlik, et suudab tõesti osakesi loendada.
Üsna tihti y-teljel on ka suhteline intensiivsus- suurima intensiivsusega piik võetakse 100%
Kuidas tekivad isotoopjooned? Millist infot need annavad?
Erinevatel elementidel on erinev arv ja erinevad isotoobid. MS on üks väheseid analüüsimeetodeid, kus isotoobid rolli mängivad ja näha on. Isotoopjoonte abil on võimalik määrata fragmendi/molekulaariooni aatomkoostist- Cl, Br sisaldus tuleb kohe välja, sest kui ühendis on kloor on isotoopjoon (M+2)+ kohal, mis moodustab M-st umbes kolmandiku, broomi korral moodustab (M+2)+ umbes poole M+ intensiivsusest.
Süsiniku isotoop 13 joon moodustab umbes 1% molekulaariooni intensiivsusest.
Molekulaarioon, fragmenteerumine. Kuidas on fragmenteerumise ulatus seotud molekuli struktuuriga?
Molekulaariooni moodustab terve molekul, kuhu on külge saadud laeng. Fragmentiooni mass on tervest molekuli massist väiksem. See, kui palju on spektris erinevaid fragmentioone sõltub ionisatsioonimeetodist.
Mida stabiilsem on laenguga molekul, (ehk kui laengu saab hästi delokaliseerida), seda vähem fragmenteerub,samas kui mingi osa molekulist suudab paremini laengut delokaliseerida, siis see saab fragment-iooniks.
Aromaatsed ühendid praktiliselt ei fragmenteeruvad vähe, hargnenud SV ja alkoholid fragmenteeruvad palju.
Nt alkoholide puhul molekulaariooni ei saagi- vesi lendub
Kui ühend sisaldab benseenituuma, siis on üsna tõenäoline, et tekib fragment, kus on benseenituum ilma 1 vesinikuta.
Miks on vaja massispektromeetrites kasutada madalaid rõhkusid (vaakumit)?
Gaasiosakesega põrkudes võib kaotada laengut, kiirus muutub, ioon võib fragmenteeruda, trajektoor muutuda. Ioonide kiirus ja suund, selle massi-laengu säilitamine on väga tähtis seega peab olema vaakum, kuna pikk vaba lennutee peab olema, et teiste osakestega ei põrkuks ja selle jaoks peab olema rõhk väga madal => vaakum.
Kuidas tekitatakse vaakum MS seadmetes?
Vaakumpump kõrvaldab ühe osa õhu molekulidest ja „asemele voolab“ uus õhk. Eelvaakumi tekitamiseks kasutatakse näiteks rotatsioonvaakumpumpa- tiiviku otsad surutakse vedrudega vastu seina, gaas väljub pumbast läbi õli, mistõttu oksüdeerivate segude pumpamisel on plahvatusoht. Kõrge vaakumi saamiseks kasutatakse turbomolekulaarpumpa (vajab eelvakumeerimist, mida saab siis saavutada turbomolekulaarpumpade abil.)
Termopaar rõhu mõõtmiseks. Tööpõhimõte.
Termopaar on keevitatud hõõgniidi külge. Hõõgniiti kuumutatakse elektrivooluga- hõõgniit jahtub seda kiiremini, mida rohkem on õhumolekule (sest põrkumise teel kandub soojusenergia kiiremini kui kiirgamise teel). Termopaar kontrollib hõõgniidi temperatuuri, sest selles tekkiv voolutugevus sõltub temperatuurist. Termopaari abil saab aparatuur aru, kui palju vajab traat kuumutamist, et püsiv temperatuur säiliks, mida rohkem vajab kuumutamist, seda halvem vaakum. Kasutatakse eelvaakumsüsteemides.
Sektor-MS tööpõhimõte.
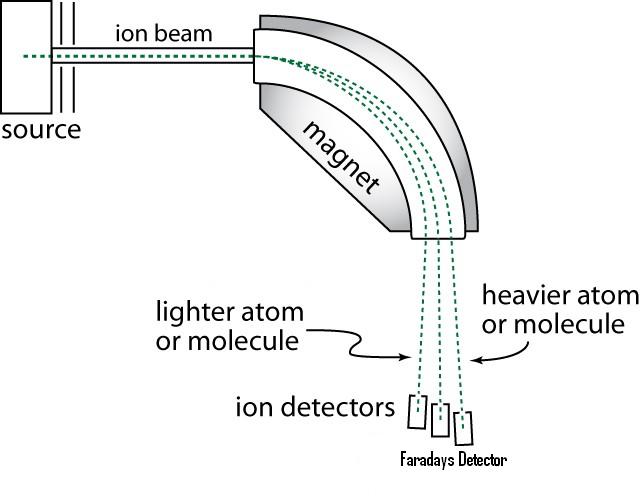 Sektor MS kasutatakse püsimagnetit või elektromagnetit selleks et panna ioonidevoolu liikuma kaare-kujulisel trajektooril.
Sektor MS kasutatakse püsimagnetit või elektromagnetit selleks et panna ioonidevoolu liikuma kaare-kujulisel trajektooril.
Ioone kiirendatakse enne analüsaatorisse minekut nii, et neil oleks orienteeruvalt sama kineetiline energia. Magnetsektori magnetväljast sõltub, millise nurga all raskemad/ kergemad ioonid sektorit läbivad ja ainult kindla m/z jõuavad detektorini. Erineva massiga ioone saab skanneerida muutes kas ioone kiirendavat potentsiaali või (kui elektromagnet) magnetvälja tugevust. (ajalooliselt esimene massianalüsaator)
Lennuaja-MS tööpõhimõte.
Ioone kiirendatakse ja lastakse siseneda nö lennutorusse, milles pole elektromagnetilist välja. Toru on umbes meeter pikk. Kergemad ioonid jõuavad enne detektorini kui raskemad.
Tüüpilised lennuajad on mikrosekundi ümber ja sp peavad detektorid olema väga nobedad.
Korratavuse ja resolutsiooni koha pealt pole nii hea, kui teised (kvadrupool, ioonlõks, magnetsektor). Samas lihtne, väga tundlik ja praktiliselt piiranguteta massivahemik kaaluvad need negatiivsed küljed nii mõnelgi puhul üle. (MALDI – TOF olid mingil perioodil väga kokkukäivad, praegusel ajal läinud laiemaks)
Kvadrupool-MS tööpõhimõte.
4 varrast, varrastel on samaaegselt alalispotentsiool ja vahelduvpotentsiaal;
kindla U ja V kombinatsiooni korral pääsevad varraste vahelt läbi ainult kindla m/z -ga ioonid (millel tekib stabiilne trajektoor), kõik ülejäänud neutraliseeruvad varrastel, sp nim ka „massifiltriks“. Kui (alalispot)U=0, siis laseb kvadrupool läbi suurema osa ioonidest
Elektronkordisti ioonide detektorina massispektromeetrites.
Detektor peab ioonist genereerima mõõdetava elektrivoolu, kuna laeng on väga väike, peaks signaali võimendama. Elektronkordisti ongi kõige tavalisem. Sellega saab võimendada voolu tavaliselt kuni 107 korda. Saab asetada kohe magnetsektori väljundpilu taha, sest selle korral on ioonide kin energia piisav, et elektrone välja lüüa. Kvadrupooli puhul tuleb ioone veel kiirendada. Kaks võimalust, kas diskreetsete dünoodidega elektonkordisti või selline sarvekujuline.
EI põhimõte, iseloomustus, plussid ja miinused.
( kiirelt liikuvaid elektrone vaadeldakse pigem lainena)
Kuumutatakse hõõgniiti, sealt pärinevaid elektrone kiirendatakse potentsiaaliga ionisatsioonikambri poole; ionisatsioonikambrisse juhitakse neutraalsed molekulid, saavad elektroniga nö pihta ja ioniseeruvad (kiirelt liikuvaid elektrone tuleks tegelikult vaadelda pigem lainena). Edasi liiguvad laetud molekulid massianalüsaatorisse.
Annab palju energiat molekulile üle- see saab tugeva ergastuse ja võib fragmenteeruda. Fragmentatsioon- mõnel juhul hea, mõnel halb; kui liiga palju fragmenteerub, ei jää alles molekulaariooni ja see on halb. Kõige sagedamini GCMS-s, sest sobib gaasifaasiliste proovide ioniseerimiseks. Kõik ained on võimalik ära ioniseerida (olgugi et võivad fragmenteeruda jne) (Anioone pm analüüsida vist pole võimalik- alati töötatakse pos ioonidega) kamber paikneb vaakumis. Küllalt lihtne seadeldis. Hinnatud et 1 molekul 1000 annab iooni. Proovi lenduvuse nõue (kõike ei saa läbi GC juhtida) Molekulmasside piirang alla 1000? daltoni. Üle selle enam lendu ei saa.
Keemiline ionisatsioon.
Mõnes mõttes nagu kaheastmeline elektronionisatsioon. Tihti riistvara võimaldab ka EI. Reagentgaasist (metaan) tekitatakse EI-ga ioonid CH4 + . Need ioonid siis omakorda reageerivad neutraalsete metaani molekulidega ja moodustuvad CH5 + . Ja CH3 . Analüüdi molekuliga võib toimuda näiteks prootoni ülekanne, saadakse ioonid (M+1)+
Oluliselt pehmem meetod kui EI. EI-st molekulaarioon on m/z suhtega, CI molekulaarioon on ühe võrra raskem [M+H]+
ESI põhimõte ja iseloomustus.
Elektronpihustusionisatsioon. Atmosfäärirõhul on ionisatsioon efektiivne. ioonid tekivad vahetult lahuses elektrivälja toimel (protoneerumine) ja „aurustuvad“ sealt välja. See on pehme ionisatsioon.
(Meil on metallplaat, kanname tilga elektrolüüti sisaldavat lahust, vastaselektrood; rakend pinge; tilgas laenguga osakesed liiguvad vastavalt potentsioolile- tilk muutub koonusekujuliseks- Taylori koonus; Rayleigh piiri- kui see ületatud hakkavad koonuse tipust väiksed tilgad eralduma. )
ESI-le iseloomulik mitmelaenguliste ioonide teke- tänu sellele saab analüüsida ka raskemaid molekule. Väga pehmed tingimused
Ioniseerumise protsess on segane ja ioniseeruvuse ennustamine tihti raske.
Jäme rusikareegel- kui molekul on lahuses ioonina, siis saab teda ka ESI-ga ioniseerida.
MALDI põhimõte ja iseloomustus.
Võimaldab analüüsi läbi viia tahkest faasist, kuid enne tuleb proovi ettevalmistus läbi viia. Proovi lahus segatakse maatriksi lahusega, aurutatakse kuivaks
Laserkiir suunatakse ühe täpi (segu väikese kuhjakese) peale. Maatriks neelab kiirgust laseri sagedusel- maatriks soojeneb, aurustub analüüdi võtab kaasa, gaasifaasis osutub see analüüdi molekul ioniseerituks. Mehhanism on jällegi täpselt teadmata – kas ioniseerumine on gaasifaasis (ergastuse kaudu), või et juba tahkes faasis. Maatriks ja laser peavad üksteisega sobituma. Analüüt ei tohi neelata laseri lainepikkust.
Väga pehme, väga vähe fragmente, põhiliselt annab ühelaengulisi ioone.
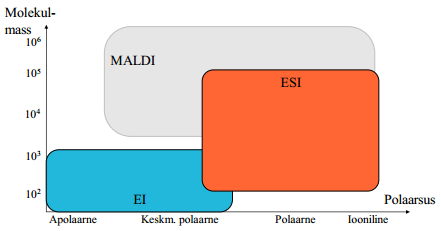
EI, ESI ja MALDI kasutusala (polaarsus-molekulmass skaalal).
EI- väiksed apolaarsed kuni keskmiselt polaarsed molekulid. (lenduvuse probleemide tõttu on piirangud)
ESI keskmise suurusega molekulid, keskmiselt polaarne kuni iooniline
MALDI- keskmiselt polaarne kuni iooniline; kasutatakse raskete molekulide (valkude jms) analüüsiks, kuigi saaks ka kergemaid analüüsida.
Millist infot annavad ainete MS spektrid?
Molekulaarioon annab aimduse, mis ainega võiks tegu olla (sama massiga erinevaid aineid on küll palju, kuid mida suurem lahutusvõime, seda kindlamini saab ainet identifitseerida), (annab aine molekulmassi, mille kaudu saab ka molekulvalemi, kui täpne mass)
Fragmendid annavad aimdust molekuli struktuurist, fragmenteerumine peaaegu nagu molekuli sõrmejälg, selle abil on võimalik aineid veel suurema kindlusega identifitseerida.
Molekulvalem isotoopsuhete järgi, ehk on võimalik kindlaks teha uuritava aine elementkoostist
Segude analüüs MS-ga.
Segude analüüsi esimeseks etapiks on sageli ikka komponentide lahutamine kromatograafiliselt: GC-MS, LC-MS, CE-MS, MS/MS ehk tandem
Kuidas saadakse mass-kromatogramm?
Mass-kromatogramm on massispektromeetria esitlusviis, kus andmeid näidatakse kromatogrammina, kus x-teljel on aeg ja y-teljel intensiivsus. Intensiivsuse allikaks on massiinfo, kuigi see pole graafiliselt mass-kromatogrammis esitatud, kuna eelistatakse graafikut intensiivsus vs aeg.
MS kvantitatiivses analüüsis.
Kui MS on ühendatud kromatograafiga, siis toimub analüüs kromatograafiliste piikide järgi. Esimest tüüpi: MS seadistatakse kindlale m/z filtreerimisele ja (või mitu ja siis vahetatakakse kiiresti ühelt piigile teisele) ja kromatogramm saadakse vastavalt nende m/z laeguga osakeste hulk vs aeg. Üldiselt on piikidealused pindalad otseselt seotud selle aine kontsentratsiooniga.
Teist tüüpi analüüsis leitakse kvantitatiivne sisaldus otse massispektri piikide kõrguse järgi kalibreerimisgraafiku meetodil. Sageli kasutatakse sisestandardit, mille ionisatsioon
peaks olema võimalikult sarnane uuritavale ühendile. Kõige paremini sobivad isotoopmärgistatud sisestandardid.
ICR massianalüsaatori tööpõhimõte
Ioonid juhitakse ICR rakku. Seal püüab tugev magnetväli nad lõksu, (tugeva magnetvälja toimel hakkavad ringimööda tiirlema on teatud sagedusega Ergastatavatele plaatidele antakse paljusid sagedusi sisaldav impulss, mille toimel ioonid hakkavad liikuma suuremal trajektooril. (see sagedus, mis iooni suuremale ringile ergastab, on sama mis tal endal iseloomulik) Selle liikumise käigus tekkivat elektrivälja registreeritakse ja registreeritud signaali Fourier teisendusel saadakse massispekter
-- külgelektroodide abil rakendatakse vahelduvpinge – õnnestub ioon lõksu püüda, tiirlema panna, alguses tiirleb väga väikesel orbiidil keskel, u 1 mm kui ..rakendatakse ergastavat vahelduvpot.. teeb suuremaid ringe, siis lõpetatakse ergastus, ja registreeritakse, kuidas suurel ringil ioon liikuv tekitab vahelduvvoolu- selle järgi saab teada, et mis m/z ioonid on ja kui palju
Ergastav pot on segu väga erinevatest sagedustest- kõik ioonid ergastatakse esialgu ja registreeritakse ioonide paketi poolt tekitatav summaarne sagedus
Fragmentatsioon eri tüüpi massianalüsaatorites.
Fragmentatsiooni saab teha kvadrupoolidega- QqQ ja ioonlõksudega, ei saa teha magnetsektoriga eriti?
Kuidas mõjutab rõhk molekuli vaba lennutee pikkust?
Mida väiksem rõhk seda pikem vaba lennutee.
Vajaliku rõhu saab arvutad valemist KIRJUTA VIHIKUSSE.
Ioonlõks massianalüsaatori tööpõhimõte.
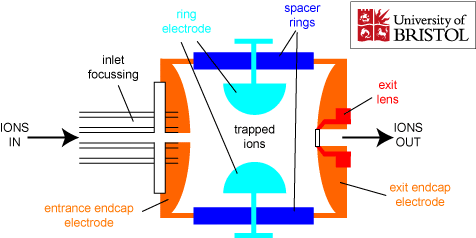 Rõngaselektroodile rakendatakse raadiosageduslik vahelduvpinge. Lõksu sisenenud ioone aeglustavad põrked He-ga. Vahelduvpinge loob lõksus kvadrupoolse elektrivälja, mis lõksustab erineva m/z ioone. Vahelduvpinge amplituudi suurenedes suurenevad ioonide trajektoorid, kergematel ioonidel kiiremini. Kui ioonide trajektoorid enam lõksu ei mahu, lendavad nad detektorisse
Rõngaselektroodile rakendatakse raadiosageduslik vahelduvpinge. Lõksu sisenenud ioone aeglustavad põrked He-ga. Vahelduvpinge loob lõksus kvadrupoolse elektrivälja, mis lõksustab erineva m/z ioone. Vahelduvpinge amplituudi suurenedes suurenevad ioonide trajektoorid, kergematel ioonidel kiiremini. Kui ioonide trajektoorid enam lõksu ei mahu, lendavad nad detektorisse
ICP-MS
Selgitage ICP-MS tööpõhimõtet ja visandage skeem!
ICP- MS korral kasutatakse induktiivsidestatud plasmat proovi aurustamiseks, atomiseerimiseks ja ioniseerimiseks, tekkinud ioone analüüsitakse massispektromeetriliselt. Proovisisestus- aerosoolina, mis tekitatakse Ar voolus. Plasmasse jõudev proovi ja solvendi hulk peab olema küllalt väike, et hoida plasma temp kõrgena. Kõrgemal temp tekib rohkem ioone ja suurem osa maatriksist laguneb. Sisestuseks kasutatakse ka HPLC, GC (metallorgaanika). Plasma tõrviku ehitus mõjutab ioniseerimise efektiivsust ja maatriksi lagundamise võimet. Tõrviku ehitus peab tagama võimalikult efektiivse proovi ioniseerirumise. Järgmine etapp on tihedalt argooni aatomeid täis kk üle minna vaakumisse, selleks väikesed avad, eelvaakum, mingi veel vahepealne vaakum ja alles massianalüsaatori (kvadrupool) juures on kõrgvaakum.
Molekulide jaoks ei sobi,
elementanalüüsiks kõige olulisem tehnika
ICP-AES ei tohi plasma ioniseerida, siin peab ioniseerima
vaakum saavutatakse järkjärgult
analüsaatoriteks kasutatakse tavaliselt kvadrupooli
kalibreerimiseks kal graafiku meetod, saab kasutada ka nö poolkvant- Mg kal graafikuga saab kalibreerida Ca ioone
Segavad mõjud ICP-MS analüüsil ja nende kõrvaldamine.
Isobaarid on segavad mõjud- kui juhtub, et 2 elemendil on sama nominaalse massiga isotoobid, siis neid nim isobaarideks, nt tina 114 ja kaadmium 114. Selle vältimiseks saab mõõta teist isotoopi, kuid kui II isotoop on vähem levinud, siis on avastamispiir viletsam.
mitmeaatomiliste ioonide masside kattumine analüüdiga,
mitmelaengulised ioonid neid eelnenud kahte saab plasma reguleerimisega parandada.
Interference equations- kasutades teadmist, et elementide looduslikud isotoopkoostised on väga püsivad, on võimalik koostada võrrandid analüüdi sisalduse leidmiseks isobaarse segaja korral (kuid mitmeaatomilise segaja korral on võrrandi kasutamine väga ebakindel.
ICP-MS meetodi karakteristikud (plussid).
Madalad avastamispiirid (ppb.. ppt)
detekteerib enamikku elemente (ca 70 elementi)
kiire: kõiki elemente määratakse samaaegselt
lai dünaamiline ala- lineaarne ala 8 suurusjärku
poolkvalitatiivne analüüs, ilma standardaineteta
isotoopkoostise analüüs.
Mis on isotoop ja isobaar?
Isotoobid- aatomid, mille tuumas on sama palju prootoneid (laeng on sama) kuid erinev arv neutroneid ja seega erinev massiarv.
Isobaar- aatomid, millel on erinev arv prootoneid, neutroneid kuid prootonite-neutronite summa on võrdne.
Radiokeemilised meetodid
Alfa-lagunemine ja beeta-lagunemine. Protsesside põhijooned, millised osakesed tekivad. Nende protsesside võrdlus. Tekkivad osakesed ja nende vastasmõju ainega.
Alfa- esineb raskete elementide aatomite juures (mass üle 150 AMÜ), tuuma lagunemine: massiarv väheneb 4 võrra, tekivad kõrge energiaga He aatomi tuumad. Võib tekkida erineva energiatega a-osakesi (piiratud hulk eri võimalusi). Nimetatakse ka ioniseerivaks kiirguseks; alumiiniumfooliumist piisab et takistada.
Beeta- raske tuuma lagunemine; neutronist saab prooton; tekivad kõrge energiaga elektronid või positronid. Elektronhaare (K-haare; tuumale kõige lähemal asuval elektroni haarab tuum endale) välja tuleb teistsugune tuumalaeng ja hv (röntgenkiirguse hv) (?PIGEM GAMMAKIIRGUSE) β-osakeste energiad on erinevad (mitte kindlalt piiritletud nagu α-osakestel). Igal lagunemisprotsessil on oma teatav maksimumenergia, millest suurema energiaga β-osakesi ei teki. Kuna elektroni mass on väike, ei tekita β-kiirgus nii efektiivselt ioonpaare kui α-kiirgus, läbimisvõime on β-kiirgusel aga suurem.
Gamma-kiirgus ja röntgenkiirgus. Mille poolest need kaks erinevad, millised on sarnasused?
Ainus, mis neid eristab, on päritolu. Samad lainepikkused ja läbistavad aineid mõlemad.
Loendurite tüübid, ehitus, tööpõhimõte.
Kasutatakse loendureid, mõõdetakse sisuliselt osakeste hulka, harva on loendur 100% efektiivne; Detektori efektiivsus- c (mitmendik suudetakse üles lugeda) Loenduskiirus R=cA ; detektorite tüübid:
gaasiga täidetud toru: Ar/ Kr/ Xe täidet toru, kiirgus saab sisse akna kaudu; igast tekkinud elektron-katioon-paarist tekib veel palju sekundaarseid kat-elektr paare, platoo tekib kuna katioonid liiguvad aeglasemalt kui elektr ja +-laengu pilv segab elektr liikumist, detekteerib β-osakesi.; olenevalt pingest jaguneb
Ionisatsioonikamber: pinge madal (alla 400V), anoodile jõuab u nii palju elektrone kui palju osake tekitab, võimendustegur ca 1, kõlbab väga energeetiliste osakeste detekteerimiseks.
proportsionaalloendur (loendatavad alfa osakesed, beeta osakesed): pinge 800..1100V Elektronide hulk kasvab pinge kasvades kiiresti sekundaarsete ioon-elektron paaride tekke tõttu, võimendustegur ca 500..10 000; vooluimpulsid suuremad; lisaks osakese detekt võimaldab registreerida ka osakese energia.
Geigeri loendur: pinge 1100...1600V, iga osake tekitab ioon-elektron paaride laviini, võimendustegur 109 pulsid intensiivsed, kõlbab kõigi osakeste jaoks. Pika surnud aja (?) tõttu ei kõlba hästi kvantitatiivseks tööks ja röntgendetektoriks.
Stsintillatsioonidetektorid: Talliumjodiid, naatriumjodiid- tekib valgussähvatus kui röntgenkiirgus peale langeb- valgus langeb metallile- fotoelektriline efekt; gamma-kiirgus. TlI-NaI asemel võib olla ka vedelik- see segatakse prooviga? Ja registreeritakse valgussähvatusi (nende arvu).
Neutronaktivatsioonanalüüs.
Tüüpline aktivatsioonimeetod. Radioaktiivsed isotoobid tekitatakse proovi sisse neutronitega kiiritamise toimel- tuumad võivad haarata neutroni endale ja kui tekkiv isotoop on radioaktiivne, siis saab kiirgust registreerida. Isotoobist eralduv kiirgus on esialgsetele elementidele karakteristlik. Neutroneid saadakse- tuumareaktorist, rad lagunemise toimel või kiirenditest, neutroneid aeglustatakse saamaks termilised neutronid (madalama kin energiaga neutronid) Määrata saab u 69 elementi.
Tegu on elementanalüüsiga, kui tekkiv kiirgus on proovi muude komponentide kiirgusest eristatav, siis saab analüüsida mittedestruktiivselt. Kuna tegu on tuumaprotsessiga, siis maatriksefektid sageli puuduvad (võib esineda omavarjestamist raskete tuumade poolt, kui neid proovis on; kerged tuumad peaaegu ei mõju??)
Isotooplahjendusmeetodid.
Viiakse molekuli sisse radioaktiivne aatom. Kindel kogus Wt (selle radioaktiivse lagunemise kiirus mõõdetakse ära Rt) radioaktiivset analüüti lisatakse proovile, kus sees mitteradioaktiivne analüüt. Homogeniseeritakse. Kokku (wt+wx)=Rt Siis ekstraheerimine (analüüdi eraldamine proovist, nt kromatograafiliselt) koguse wm ; ekstraheerimise käigus pole vaja eraldada kogu analüüti; saagis pole oluline; mõõdame wm lagunemiskiiruse. Kehtib võrrand Rm/wm=Rt/(wx+wt) mõõdetud_radioakt /kogus = lisat_radioakt /(kogus_lisat+kogus algne),
millest saab avaldada wx. Kuna puudub täieliku eraldamise vajadus, siis saab eraldada väga puhtalt ja saavutada kõrge selektiivsuse.
Samuti on kiirguse mõõtmine üsna täpne, kaalumine samuti; seega tulemuse usaldusväärsus on väga kõrge.
Tähtis on korralik segunemine. Rakendatav nii elementide kui ka ühendite analüüsiks.
