Kordamisküsimused eksamiks aines Füüsikaline keemia II
Lisamise aeg:
2015-08-14 11:36:41Vaatamiste arv:
12971Tagasiside:
1 1Kordamisküsimused eksamiks aines Füüsikaline keemia II
Õppeaasta 2012/13 kevadsemester
Dokument on mõeldud väljaprintimiseks, et siis lünkadesse valemeid ja tuletuskäike kirjutada
Elektrokeemiline tasakaal
Selgita, mille poolest erinevad galvaanielement ja elektrolüüser. Kirjuta galvaanielemendis ja elektrolüüseris toimuvad põhimõttelised poolreaktsioonid. Mis on redutseerija, oksüdeerija ja redokspaar?
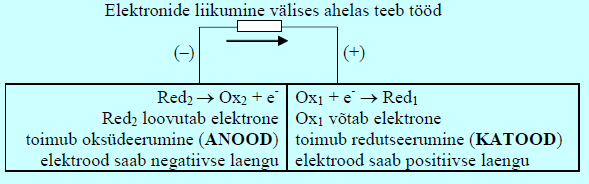 Galvaanielemendis toimub spontaanne reaktsioon (toimuv protsess on isevooluline) ja selles vabanevat energiat kasutatakse elektri saamiseks.
Galvaanielemendis toimub spontaanne reaktsioon (toimuv protsess on isevooluline) ja selles vabanevat energiat kasutatakse elektri saamiseks.
Galvaanielemendis on anood negatiivne!
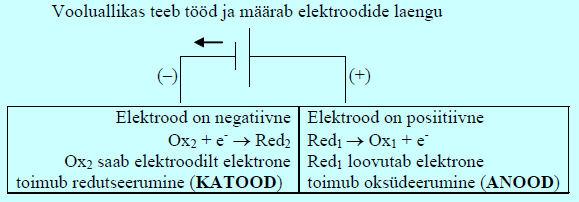 Elektrolüüser on aga seade, kus elektrit rakendatakse mitteisevoolulise elektrokeemilise reaktsiooni läbiviimiseks. Elektrolüüseris on anood positiivne!
Elektrolüüser on aga seade, kus elektrit rakendatakse mitteisevoolulise elektrokeemilise reaktsiooni läbiviimiseks. Elektrolüüseris on anood positiivne!
Redokspaariks nim Ox1/Red1 (Ox1+ e- = Red1)
Nernsti võrrand (tuletuskäiguga).
Toimugu elektrokeemilises rakus pöörduv reaktsioon aA + bB = cC + fF
Reaktsiooni isotermi võrrandi alusel :
Avaldame raku nullvoolupotentsiaali E:
kus Q= on nn reaktsioonikorrutis, kus lähteainete koefitsendid on negatiivsed, sest nende kontsentratsioonid vähenevad reaktsiooni käigus.
Võrrandi esimest liiget nimetatakse raku standardpotentsiaaliks (e stand. 0-voolupot)
Arvestades reaktsiooni standardse Gibbsi energia seost reaktsiooni tasakaalukonstandiga
saame st pot seose reakts tasakaalukonstandiga
Raku nullvoolupotentsiaali jaoks avaldis:
See on Nernsti võrrand. Nernsti võrrand seob raku nullvoolupotentsiaali reaktsioonis osalevate ainete aktiivsustega elektrokeemilises rakus.
Mida suurem on rakupot, seda rohkem on rakk võimeline tegema elektrilist tööd. Protsessi käigus rakupot väheneb ja koos sellega ka töövõime
Kuna reaalne protsess pole enamasti pöörduv, siis tegelik töövõime max-st väiksem.
Reaktsiooni G energia sõltub temperatuurist ja seega ka raku nullvoolu- ning standardpotentsiaal sõltuvad temperatuurist.
Rakupotentsiaali temperatuurisõltuvus (tuletuskäiguga).
Rakupotentsiaali temperatuurisõltuvuse põhjal saab välja arvutada reaktsiooni soojusefekti ja entroopiamuutuse:
Rakureaktsiooni termodünaamiliste parameetrite entroopia, entalpia ja Gibbsi energia ning rakupotentsiaali ja raku standardpotentsiaali sõltuvus temperatuurist. KÜS
Siin tuletused väikese selgitusega, kust valemist pihta hakkab ja mis tingimustel saab asendada.
Elektrokeemilise elemendi potentsiaali ja standardpotentsiaali seosed elektrilise töö, reaktsiooni Gibbsi energia ja standardse Gibbsi energiaga.KÜS
Maksimaalne võimalik töö on võrdne gibbsi energia siis p, T ei muutu kui protsess toimub iseeneslikult ja pöörduvalt,
Elektriline töö (A=IUt) 1 mooli suvalise laenguga (z) osakeste liigutamiseks kulub energiat W = -zFE (F on 1 mol 1laenguliste ioonide liigutamiseks 1V võrra neg pot-le)
Järelikult vabaneb pöörduva elektro
Millised on vajalikud tingimused, et rakupotentsiaal oleks seotud rakureaktsiooni Gibbsi energiaga? Kuidas on võimaliks neid tingimusi eksperimentaalselt tagada?
Selleks, et rakupotentsiaal oleks seotud rakureaktsiooni Gibbsi energiaga, peaks reaktsioon toimuma pöörduvalt. (Pööruv protsess teeb max tööd) Seega reaktsiooni komponentide kontsentratsioon ei tohi muutuda. Seda on võimalik saavutada, kompenseerides rakupotentsiaali välise vooluallika abil. Sel juhul süsteemi vool ei läbi ja sealt tulebki nimetus – nullvoolupotentsiaal. Teine võimalus on veel: elektroodide vahele ühendada lõpmatult suure takistusega juht, siis on vamuti voolutugevus lähedane 0-le.
Reaktsioonikorrutis (/jagatis) ja tasakaalukonstant ning nende seosed rakupotentsiaaliga.
Iostermi võrr analüüs- mis võrdub millega kui miski on 0
Koosta etteantud poolreaktsioonide põhjal elektrokeemilise elemendi skeem, näita standardpotentsiaalide põhjal, mis oksüdeerub ja mis redutseerub. Kirjuta summaarne reaktsioon, poolelementide ja kogu raku Nernsti võrrandid (potentsiaalide avaldised).
Isevoolulise protsessi kohta: anood vasakul, katood paremal (positiivsem paremal)
Reduktsiooni standardpotentsiaal ja oksüdatsiooni standardpotentsiaal. Standardpotentsiaalide tabel (mis põhimõttel koostatud, temperatuuri mõju). KÜS- standard paneb ette rõhud, aktiivsused, iga temp juures on olemas st gibbsi energia, on temp fun igal juhul
Ox1 + z*e- = Red1 sellele vastab reduktsioonipotentsiaal:
Red2 – z*e- = Ox1 sellele vastab oksüdatsioonipotentsiaal:
Standardpotentsiaalide tabelis on antud reduktsioonipot. (Oksüdatsioonipot on sama, kuid vastasmärgiline)
Poolreaktsioonide standardsed reduktsioonipotentsiaalid ehk standardpotentsiaalid väljendatakse kokkuleppeliselt standard-vesinikelektroodi
Pt(s) | H2(g,pH2 = 1 bar) | H+(aq, aH+ = 1)
suhtes, mille standardne nullvoolupotentsiaal loetakse suvalisel temperatuuril võrdseks nulliga.
Elektroodi standardpotentsiaal on vastava poolreaktsiooni standardnepotentsiaal standardvesinikelektroodi suhtes standardtingimustes (reagentide aktiivsused võrdsed ühega).
Poolelement, standardvesinikelektrood ja normaalvesinikelektrood. Standardvesinikelektroodi olulisus.
Poolelement: süsteem, mis koosneb elektroodist ja seda ümbritsevast elektrolüüdi lahusest
Standardvesinikelektrood: Pt(s) | H2(g,pH2 = 1 bar) | H+(aq, aH+ = 1)
Normaalvesinikelektrood ehituselt sama, kuid vesiniku rõhk on 1atm.
Tähtis, sest poolreaktsioonide standardpotentsiaalid on antud selle suhtes.
Rakupotentsiaali seos lahus(t)e kontsentratsiooni(de)ga ning ioonide aktiivsusega lahus(t)es. KÜS (Q ongi seos, seos aktiivsustega, kui lahjad lahused, siis saaab kontsentratsiooniga, tasakaalulises igal juhul kindlad konts, Q on lahuses akt)
Rakupotentsiaali avaldise saame kui lahutame positiivsema standardpot-ga poolreaktsiooni potentsiaali avaldisest neg-ma pot-ga poolreaktsiooni avaldise. Otseselt sõltub potentsiaal ioonide aktiivsusest lahuses, kuna aktiivsus on aktiivsuskoefitsendi ja kontsentratsiooni korrutis, siis sõltub ka kontsentratsioonist.
Rakupotentsiaali sõltuvus gaaside osarõhkudest gaaselementides.
Rakupotentsiaal sõltub otseselt reaalse gaasi fugitiivsusest, aga kuna fugitiivsus sõltub omakorda gaasi osarõhust ja enamasti ei tehta osarõhkude kasutamisega suurt viga, siis sõltub ka sellest. Võib panna Nernsti võrrandis kohe kontsentratsioonide asemele.
Difusioonipotentsiaal ja selle vältimise võimalused.
Difusioonipotentsiaal on lahustevahelisel piirpinnal ioonide erinevate liikuvuste tõttu tekkiv potentsiaalihüpe
Avaldis:
Vältida saab:
Elektrolüütilise silla abil (mis eraldab anoodi-katoodiruumi): see on täidetud elektrolüüdiga, mille liikuvused on sarnased. Kui elektroodiruumides hakkab kuhjuma laengut (anoodiruumis kuhjub pos laeng, katoodiruumis negatiivne), siis soolasild vabastab endast vastavaid ioone, et elektroneutraalsus säiliks ja vool edasi kestaks (ilma, et lahused seguneksid)
KONTSENTRATSIOONIELEMEND Saab ka üldjuhul, muudel juhtudel ei saa mat arvutada , kui pole konts element, sest on keerukas määrata eksper, seelle pärast kasut Kcl, võrdsed liikuvused!!!! KÜS- Difusioonipotentsiaali saab vältida ka ühendades 2 sama ehitusega aga erineva kontsentratsiooniga lahust sisaldavat elementi omavahel. Sellist süsteemi nimetatakse ülekandeta kontsentratsioonielemendiks ja selle potentsiaal on 2 korda suurem kui samade lahuste ja elektrolüütsillaga elemendi potentsiaal.
Difusioonipotentsiaali avaldis poolläbilaskva ja läbilaskva membraani korral (tuletuskäigud)
POOLLÄBILASKEV:
Kui 2 erineva kontsentratsiooniga sama aine lahust on eraldatud teineteisestpoolläbilaskva membraaniga, siis hakkavad ioonid keemiliste potentsiaalide erinevuse tõttu difundeeruma läbi membraani kõrgema kontsentratsiooniga lahusest madalama kontsentratsiooniga lahusesse. Olgu 2 erineva Hcl lahused eraldatud sellise membraaniga, et H- pääseb läbi, Cl- ja lahusti molekulid mitte. Kui a2 > a1, siis keemiliste potentsiaalide erinevusest tingitud protsessi G energia on:
Kuna protsess on isevooluline, siis G energia peab olema neg. (ongi, sest valemis a1 < a2). Kuna ainult H+ saab läbida, siis laadub 1 pool positiivselt, teine negatiivselt. H+ elektriväljast läbi viimiseks vaja minev energia on proportsionaalne membraanil kasvava potentsiaalihüppega:
Kui saabub tasakaal, siis summaarne G muut saab võrdseks 0-ga
Siit saab avaldada ifusioonipotentsiaali:
Kuna a2 > a1 siis on dif pot positiivne. Kuna dif on spontaanne protsess, siis:
Enamasti läbivad membraani aga mõlema laengumärgiga ioonid. Siis tekib dif pot ioonide erinevate liikuvuste tõttu. H+ liikuvus on palju suurem kui Cl- ja ikkagi saab membraani vasak pool (see, kuhu mõlemad minna üritavad) pos laengu, kuid pot membraanil on selle võrra väiksem, et ka osa neg ioone läbib membraani. Seega:
Kui anioonide ülekandearv on suurem kui katioonide ülekandearv, siis laadub membraan vastupidiste märkidega. Kuna dif on endiselt iseeneslik (ehk dif pot >0), siis vahetavad t+ ja t- valemis oma kohad. Seega üldjuhul:
Galvaanielementide liigid. Elektrolüütsilla mõte süsteemis ning elektrolüüdi valiku põhimõte elektrolüütsilda.
Galvaaanielemendid jaotatakse:
Keemilised galvaanielemendid: muundavad keem reakts energia elektrienergiaks
elektroodid samas lahuses: lihtsaim rakk, kaks elektroodi sukeldatud samasse lahusesse, nt H-elektrood ja Ag/AgCl-elektrood soolhapp lahuses:
poolläbilaskva membraaniga elemendid: enamasti anood-katoodruumi lahused erinevad ja eraldatud poolläbilaskva membraaniga. Sellele membraanile tekib ioonide eri liikuvuste tõttu potentsiaalihüpe
elektrolüütilise sillaga elemendid: kuna pot hüpet 2 lahuse piirpinnal on tihti raske määrata, tahetakse seda vältida. Selleks kasutatakse elektrolüütsilda. Elektrolüütsilla sees oleva elektrolüüdi ioonide liikuvused peaks olema umbes võrdsed
kontsentratsioonielemendid: galvaanielement, mis teeb tööd kontsentratsioonigradiendi arvelt. Erineva kontsentratsiooniga võiva olla nii lahused kui ka elektroodid (amalgaamelektrood). Elemendid võivad olla pöörduvad kas katiooni või aniooni suhtes.
Kontsentratsioonielemendid (amalgaamelement, katioonide ja anioonide suhtes pöödruvalt töötavad elemendid, elektrolüütsillaga ja ülekandeta kontsentratsioonielemendid, vastavad skeemid selgitustega ja valemid).
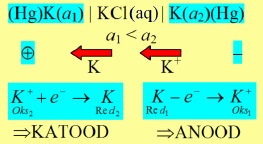 AMALGAAMELEMENT
AMALGAAMELEMENT
Amalgaamelektroodides on kaaliumi kontsentratsioon erinev. Kuna paremal on K+ aktiivsus suurem, siis sealt hakkab K lahusesse minema
K jätab minnes oma elektronid elavhõbedale ja see elektrood saab neg laengu.
Seega vasak saab positiivse.
Poolelementide potentsiaalid:
ja rakupotentsiaal:
Kontsentratsioonielemendi st pot on 0, kuna süsteem ei tööta juhul kui aktiivsused on võrdsed. Kuna konts elemendis toimuv protsess on isevooluline, siis peab selle pot >0
KATIOONIDE SUHTES PÖÖRDUVALT
Konts gradient sunnib H+ ioone paremast (suurema
konts) anumast lahkuma elektroodile (eraldub
vesinik) ja seetõttu saab see elektrood +-laengu.
(Seega elektrivälja suund paremalt vasakule)
Difusioonipotentsiaal aga tekitab elektrivälja,
mille suund on vasakult paremale. Seega, kuna tekkinud elektriväljad on vastupidise suunaga, siis dif pot vähendab elektrilist potentsiaali. Seega on summaarne rakupotentsiaal elektrilise ja dif pot vahe. Kui oleks samasuunalised elektriväljad, siis pot liituksid
t+ > t- , siis
t- > t+ , siis
Mõlemad annavad sama tulemuse:
ANIOONIDE SUHTES PÖÖRDUVALT TÖÖTAV ELEMENT
Asendades eelmises süsteemis H-elektroodid
Cl-elektrooidega, vahetavad vasak ja parem
pool märki, seega muutub ka elektrokeemilise
protsessi tekitatud elektrivälja suund
Analoogiliselt eelmise näitega:
ELEKTROLÜÜTSILLAGA KONTSENTRATSIOONIELEMENT
Vaatleme, kuidas elektrolüüdisild kõrvaldab difusioonipot.
Element, kus anoodi-katoodiruum eraldatud el lüüt silla
abil, mis täidet KNO3. Kuna liikuvused enam-vähem
võrdsed, siis
ÜLEKANDETA KONTSENTRATSIOONIELEMENT
Dif pot saabelimineerida ka ühendades 2 sama
ehitusega, aga erineva kontsentratsiooniga
lahust sisaldavat elementi omavahel. Siin
töötavad H-elektrood H+ iooni suhtes pöörduvalt
ning Ag/AgCl Cl- iooni suhtes pöörduvalt
Vasakpoolse raku reaktsioon:
ja rakupotentsiaal:
Paremal pool toimub vastupidine reaktsioon, järelikult:
Summaarne potentsiaal:
Ülekandeta konts elem pot on 2 korda suurem kui samade lahustega ja el lüüt sillaga elemendi pot.
Elektroodide liigid (tööülesande järgi ja elektroodimaterjali ning osalevate ainete järgi).
Elektroodid jaotatakse tööülesande järgi:
Võrdluselektrood: elektrood, mille pot ei sõltu lahuse koostisest ning on ajas püsiv.
Tööelektrood: selle potentsiaal sõltub elektroodiga tasakaalus olevate ioonide kontsentratsioonist lahuses
Lahuse koostisosade suhtes liigitatakse elektroodid:
I liiki: katiooni suhtes pöörduvalt töötavad elektroodid
II liiki: aniooni suhtes pöörduvalt töötavad elektroodid
III liiki: redokselektroodid- tasakaal tekib lahuses eri o-a ioonide vahel
Koostisosade järgi jaotatakse:
metall/metalli ioon
gaaselektroodid
metall/rasklah sool või oksiid, anioon/katioon
inertne elektrood ja erineva o-a ioonid lahuses (nn redokselektrood)
Ioonselektiivsed elektroodid.
ISE on membraanelektroodid, mille membraani ja lahuses oleva kindla iooniliigi või lahustunud gaasi vahel tekib tasakaal. ISE elektroodide töö põhineb Nikolski-Eisenmani võrrandil. Mis on Nernsti võrrandi moodi, kuid seal on ka arvestatud segavaid ioone (potentsiaal ei sõltu mitte ainult uuritavast ioonist vaid ka segavate ioonide kont, mis korrutatud läbi sellise konstandiga, mis iseloomustab, kui tundlik membraan segava iooni suhtes on).
ISE tüüpiline näide on klaaselektrood. Selle põhiosa on õhukeseseinaline klaaskuulike, milles on muutumatu pH-ga lahusesse (kas HCl või Kcl puhverlahus) sukeldatud abielektrood. SKEEM:
Klaasmembraani ja uuritava lahuse vahel toimub ioonvahetus ja tekib tasakaal:
Mis on tööelektrood ja võrdluselektrood ning mille poolest need erinevad?
Tööelektrood on elektrood, mille pot sõltub temaga tasakaalus olevate ioonide kontsentratsioonist uuritavas lahuses.
Võrdluselektrood on aga elektrood, mille pot ei sõltu uuritavast lahusest.
Tööelektrood on kas otse sukeldatud lahusesse või on sellega membraani kaudu ühendatud. Võrdluselektrood on uuritava lahusega vaid soolasilla kaudu ühendatud.
Võrdluselektrood. Selgita, kuidas tagatakse see, et võrdluselektroodi potentsiaal ei sõltu uuritava lahuse koostisest?
Võrdluselektrood- elektrood, mille pot ei sõltu lahuse koostisest ning on ajas püsiv.
Konstantne pot tagatakse nii, et elektroodi siselahuse kontsentratsioon on pidevalt sama. Näiteks Ag/AgCl elektrood: elektrood on sukeldatud teatud kontsentratsiooniga Kcl vesilahusesse (siselahusesse). Tekib tasakaal hõbe/hõbekloriid elektroodi ja võrdluselektroodi siselahuses olevate Cl- ioonide vahel. Ning kuna siselahuse konts ei muutu, siis on võrdluselektroodi pot konstantne ning ei sõltu ka selle lahuse konts, millesse ta on sukeldatud
Selgita, millistel elektrokeemilise tasakaalu teoreetilistel alustel põhineb pH potentsiomeetriline määramine. KÜS-
Mitmete elektroodidega-kuna pot on otseslt seot H konts, siisSAAB SELLISE ELEKTROODIGA; MILLE POT SÕLTUB H pot ja siis pot järgi saab arvut pH
TORE; KUI Millestki muust ei sõltu. RÄÄRGI KA võrdluselektroodist, tuleb kontrollida, et ei sõltuks võrdl elektroodi pot
Klaasmembraani ja uuritava lahuse vahel tekib tasakaal:
Kui mõõdetav lahus on happeline või nõrgalt aluseline, siis ja
Kui uuritav lahus on aluseline, siis ja
ning klaaselektrood ei tööta enam pöörduvalt H-ioonide suhtes vaid metalli ioonide suhtes.
Võrdle erinevaid pH määramise meetodeid. KÜS-
võrdlema kolorimeetrilise tiitrimisega, pot tiitrimist (värvusega vrld pot )
Enimkasutatavad pH-elektroodid on vesinikelektrood, kinhüdroonelektrood, klaaselektrood. Enamasti kasutatakse klaaselektroodi.
Võrdle ühe- ja mitmeprootonihappe tiitrimiskõveraid. KÜS
Üheprootonihappe tiitrimiskõveral on suur hüpe, mitmeprootonihappe tiitrimiskõveral on mitu hüpet ja need on madalamad. (MIS POTIS; MIS KÜVETTIs, et saada seda kõverat, kuidas tekib, igal pK-le vastavad punktis oma tasakaal mis ioonid tasakaalus )
Selgita, kuidas saab potentsiomeetrilise tiitrimise andmetest määrata hapete dissotsiatsioonikonstante. KÜS LÕIGU KESKELT; UMBMÄÄRASELT
Kui 2 tasakaalus oleva iooni aktiivsused on võrdsed, siis pH =pKa
Selgita tugeva ja nõrga happe segu tiitrimise teoreetilist tagapõhja.
Kahe happe segus on täielikult dissotsieerunud tugevam hape, seega H+ liig lahuses tõrjub nõrga happe dissotsiatsiooni tagasi. Nii saabki, et segu tiitrides tuleb esimene hüpe siis, kui tugevam hape on ära reageerinud ja järgmine(sed) siis kui nõrk hape on ära tiitritud.
Lahuse keskmise aktiivsuskoefitsiendi määramine elektrokeemiliselt.
Rasklahustuva soola lahustuvuse teel
Koostatakse rasklahustuvat soola sisaldav rakk:
Teades lahustuvuskorrutist KL , saab aktiivsuskoefitsendi määrata Nernsti võrrandist tuletatud avaldisest:
Teine võimalus:
Koostatakse element, kus 1 elektrood töötab pöörduvalt lahuste 1 iooni suhtes ja teine elektrood teise iooni suhtes:
Arvestades, et ja saame:
Selgita redokstiitrimise põhimõtteid.
Lahusesse sukeldatakse indikaatorelektrood, mille pot määravad lahuses olevad redokspaarid, kuid mis ise elektrooditasakaalus ei osale (Pt-elektrood) ja võrdluselektrood, mille pot ei olene lahuse koostisest.
Süsteemi saab tiitrida, kui redokspaaride st pot erinevus on >=0,2 V; kui redokssüsteem on tundlik O2 suhtes, siis tuleb tiitrida inertgaasi kk; kui pot sõltub H+ aktiivsusest, tuleb kasut puhverlahuseid või tugevalt happelisi/aluselisi lahuseid
Näiteks reaktsioon:
Lahuses on 2 redokssüsteemi, indikaatorelektroodil saab olla aga vaid 1 potentsiaal:
Seega:
Kuni stöhh punktini ioone lahuses praktiliselt pole, sest reageerivad ära, pot määrab Fe2+/Fe3+ tasakaal
Stöhh punktis valem :
Pärast stöhh punkti määrab lahuse potentsiaali mangaani tasakaal:
Kirjelda rasklahustuva soola lahustuvuskorrutise määramist lahuse elektrijuhtivuse määramise teel ja rakupotentsiaali määramise meetodil ning võrdle neid meetodeid.
Lahuse elektrijuhtivuse määramise teel:
Lahuse juhtivus on summa soola ja vee juhtivusest:
Erijuhtivus- juhtivus * nn elektroodide konstant.
Kontsentratsioon: , kus mooljuhtivus lõpmatul lahjendusel:
Lahustuvuskorrutise määramist elektrijuhtivuse mõõtmise teel segavad lisandid (kergemini lahust soolad, vees lahust CO2)
Lahustuvuskorrutise määramine rakupotentsiaali mõõtmise teel:
.. eeliseks see, et kergemini lahust lisandid ei sega mõõtmisi, (kui nad just ei mõjuta aktiivsuskoef või sisalda uuritavada samu ioone)
1) koostatakse rakk, mis koosneb võrdluselektroodist ja metall/rasklahustuv sool elektroodist. Leitakse poolelemendi potentsiaal SHE suhtes. Arvestades st pot ning poolreaktsiooni tasakaalukonst vahelist seost ja lahustuvuskorrutise valemit, saadakse:
Analoogia põhjal:
Teeme vastavad asendused ja saame
Kuna aniooni konts on teada (ilmselt ka gamma), saame leida lahustuvuskorrutise
2) Kontsentratsioonielemendi abil: näiteks oleks vaja määrata BaSO4 lahustuvuskorrutis. Selleks koostatakse konts element:
vasaku elektroodi ruumi lisatakse nt Ba(NO3)2 , et elektrood hakkaks pöörduvalt töötama Ba2+ suhtes. Viimase aktiivsuse lahuses määravad aga lahustuvuskorrutis ja SO4 2- ioonide kontsentratsioon lahuses ( ). Kuna sellise elemendi mõlemad elektroodipot sõltuvad Ba2+ ioonide c-st, saame:
Aktiivsus parema elektroodi ruumis on teada, seega saab arvutada Ba2+ aktiivsuse vasaku elektroodi ruumis ning KL = aBa2+ *aso4
Raku ja poolelemendi standardpotentsiaali määramine.KÜS
Standardpotentsiaale saab määrata raku 0-voolupotentsiaali mõõtmise teel.
Kui lahuse kontsentratsioon läheneb 0-le, siis aktiivsuskoef läheneb 1-le ja vasaku poole väärtus läheneb st pot väärtusele. Leides graafiku, kus sõltuvus mingil kujul kontsentratsioonist ( ) on sirge, siis selle sirge ekstrapoleerimisel m=0-le saab määrata E0 .
Konduktomeetria
Konduktomeetrilise tiitrimise meetod põhineb sellel, et tiitrimisel asenduvad lahuses toimuva reaktsiooni tulemusena ühe liikuvusega ioonid teise liikuvusega ioonidega ning lahuse elektrijuhtivus muutub. Koostatakse graafik elektrijuhtivuse sõltuvus lisatud titrandi ruumalast. Graafikul esinevate murdepunktide alusel määratakse stöhhiomeetriapunkt(id).
Meetod on rakendatav nii neutralisatsiooni-, vahetus- kui ka sadestusreakts korral. Tiitrimist segavad kõrvalised elektrolüüdid, mis muudavad elektrijuhtivuse suhteliselt väikeseks ning raskesti määratavaks. Näidisgraafikud:
Pourbaix diagrammid
Kirjelda Pourbaix’ diagrammide koostamise põhimõtteid.
Diagrammid koostatakse Nernsti võrrandite ja tasakaalukonstantide avaldiste alusel tasakaaluliste reaktsioonide kohta. On kolm võimalust:
puhta laenguülekandega elektrokeemilised reaktsioonid- horisontaaljooned, kuna ei sõltu pH-st
Joone võrrand Nernsti võrr alusel.:
puhtad hape-alus-reaktsioonid- vertikaaljooned, sest ei toimu o-a muutust.
Joone võrrand tasakaalukonst avalduse põhjal:
H+ või OH- ioonide osalusega redoksreaktsioonid- diagonaaljooned
Joone võrrand saadakse nii ilmutades Nernsti võrrandist teisenduste käigus pH.
Kuidas tekivad Pourbaix diagrammile horisontaal- vertikaal- ja kaldjooned ning mis määrab kaldjoonte tõusu?
Horisontaaljooned: reaktsioon ei sõltu pH-st
Vertikaaljooned: reaktsiooni käigus ei muutu o-a.
Kaldjooned: sõltub nii pH-st kui ka redokspotentsiaalist. Kaldjoonte tõusu määrab see, kui palju vesinik/hüdroksiidioone 1 elementaarreaktsioonis osaleb.
Kuidas mõjutab vesiniku rõhk vesiniku eraldumist ja hapniku rõhk hapniku eraldumist vesilahustest?
Vesinik:
Võrrand:
Kui Pt elektrood on vees, mille pH = 7 ja mille kohal
H2 rõhk on 1 atm, siis Pt potentsiaal on
Kui alandada potentsiaali näiteks ,siis
hakkab vesi lagunema, et saavutada uut tasakaalu.
(kas suureneb vesiniku osarõhk või pH)
Hapnik:
Võrrand:
Kui vesi on tasakaalus O2-ga rõhul 1atm, pH =7
ja E= +800 mV ning pot tõsta, siis vesi hakkab lagunema
O2 eraldub seni, kuni saabub uus tasakaal kas kõrgemal
hapniku rõhul või madalama pH juures.
Selgita metalli X (näiteks Ni) Pourbaix diagrammil märgitud jooni antud graafiku reaktsioonivõrrandite alusel.
Kas metalli Z sukeldamisel happe lahusesse, mille pH=D, hakkab vesinik eralduma? Põhjenda oma vastust. Selgitustes eelda, et vesiniku ülepinge sellel metallil on null.
Kuidas mõjutab vesiniku kõrge (madal) ülepinge metallil Y vesiniku eraldumist?
Kui vesiniku eraldumiseks metallil peab rakendama kõrget ülepinget, siis see tähendab et metall korrodeerub vähem. (Vaja on tasakaalulisest veel negatiivsemat pot, et H2 eralduks). Selleks, et vesinik hakkaks eralduma ja metall lahustuma, peab metalli lahustumise potentsiaal antud konts ja pH juures olema madalam kui vesiniku eraldumise pot selle pH juures (kui metall joon madalam, siis eraldub vesinik, kui mitte, siis ei eraldu).
Selgita, kas ja kuidas metall R oksüdeerub vesinikujoonest kõrgematel potentsiaalidel, vesiniku- ja hapnikujoone vahelisel alal ja hapnikujoonest kõrgematel potentsiaalidel.
Metall R ei saa vesinikujoonest kõrgematel potentsiaalidel vesiniku toimel oksüdeeruda. Selleks peab ta oma elektronid ära andma- vesinikujoonest kõrgemal- seega metalli reduktsioonipot on kõrgem kui vesiniku oma, seega TD on võimalik reaktsioon, kus metallikatioon võtab elektrone juurde ja sadeneb, Gaasiline vesinik annab elektrone ära ja muutub vesinikiooniks. Kuna reaalsetes protsessides gaasilist vesiniku pole, siis soodustatud reaktsiooni ei toimu.
Vesiniku ja hapniku joone vahelisel alal võib metalli käituda redutseerijana gaasilise hapniku toimel. Hapniku joon on metallijoonest kõrgemal seega hapnik oksüdeerija, metall redutseerija ning metall lahustubki.
Hapnikujoonest kõrgematel potentsiaalidel metall redutseerijana käituda ei saa, sest olles kõrgemal, peaks ta vee suhtes olema oksüdeerija, ehk võtma elektrone juurde.
Keemilised vooluallikad
Primaarpatareid KÜS
.. ei ole korduvalt laetavad, sest protsessid on pöördumatud. KONREETSEID PATAREID EI KÜSITA
Sidrunipatarei
Danielli element; Zn- Cu element
Leclanché element, Zn-süsi- patarei, kuivelement; odav, mittemürgine, ebastabiilne potentsiaal ja vool
Leelispatarei: kui patareid ei kasutata, siis Zn-elektroodil reaktsiooni ei toimu, pikem eluiga
hõbepatarei: potentsiaal püsib pikka aega, väikesti mõõtmetega, kallis
Sekundaarpatareid
Põhinevad pöörduvatel protsessidel, tuleb enne kasutamist laadida ning neid saab teatud arvu kordi uuesti laadida.
Pliiaku: madal erienergia, suur võimsustihedus, saastab pliiga, võib tekitada vesinikku ja plahvatada
Nikkel-kaadmium aku; nikkel- metalli hüdriid aku
Li-ioon patarei?, mitmete erinevat tüüpi MO (metalli oksiidid?), elektrolüüdiks Li-sool org lahustis
Heterogeensete reaktsioonide kineetika
Difusioon
Statsionaarne difusioon, Fick’I I seadus (tuletuskäik)
Vaatleme toru, milles toimub osakeste liikumine kõrgema konts osast madalama konts ossa. Eeldame, et toru algust ja lõppu läbiv osakeste hulk on võrdne ( dn1 =dn2 = dn). Vaadeldavat ruumiosa läbiv ainehulk on võrdeline ajaga dt, toru ristlõikepindalaga S ning kontsentratsioonigraiendiga dc/dx
kus D on difusioonikoefitsent, mis arvuliselt näitab sekundis läbi ruutmeetri suureuse pinna dif-nud aine hulka, kui dc/dx = 1. („-“, sest dc/dx on negatiivne)
Võrrandi kuju muutes saab:
milles dn/Sdt = J on ainehulga torus liikumise kiirus ehk osakeste voog ühikulist ristlõikepinda läbiv ainehulk ajaühikus. Vaadeldavas ruumiosas osakeste dn ei muutu, seega on ka osakeste voog kogu ruumiosas konst => nimetatakse statsionaarseks difusiooniks
Ficki I seadus: statsionaarse difusiooni kiirus ehk osakeste voog läbi ühikulise ristlõikepinna on võrdeline kontsentratsioonigradiendiga.
Difusioon keemiliste potentsiaalide erinevuse toimel (tuletuskäik).
Konsts muutuse saab avaldada keemilise pot muutuse kaudu. Selleks tuleb võtta tuletis
võrrandist ning saame
Kui vaadelda süsteeme, kus aktiivsused on väikesed, siis saab teha lihtsustusi:
Avaldame konts muudu: ja viime selle Ficki I võrrandisse ning saame difusioonivoo sõltuvuse keemilise pot gradiendist:
Mittestatsionaarne difusioon, Fick’i II seadus (tuletuskäigud)
Mittestatsionaarset difusioon: difusioonivoog ei ole kogu süsteemi ulatuses konstant.
Vaatleme ühikulise ristlõikepindalaga toru, mille
algosas kaugusel x on dif voog Jx ning kaugusel
(x+dx) on dif voog J(x+dx). Konts muutus
märgitud ruumiosas on dc ja ruumiosa läbimiseks
kuluv aeg on dt. Difusioonivoog kaugusel (x+dx) on : Kogu dif voog
läbi märgitud ruumiosa on seega
Kontsentratsioonimuutus ajas on võrdne difusioonivoo muutusega ruumalaühiku kohta:
Asendades J Fick'i I võrrandist, saame Kuna D ei sõltu kaugusest x,
saame - See on Fick'i II seadus.
Heterogeensed reaktsioonid
Difusioonlimiteeritud heterogeensed protsessid (üldiseloomustus).
Heterogeense reaktsiooni kiiruse puhul tuleb tavaliselt arvestada aine ülekandeprotsesside aegluse mõju. Aine ülekandeprotsessiks on valdavalt difusioon, mis toimub kontsentratsioonide erinevuse tõttu faasi sisemuses ja piirpinnal. Mida suurem on kontsentratsioonide erinevus, seda kiiremini toimub difusioon, seega difusioon toimub kõige kiiremini kui pindkontsentratsioon on ligilähedaselt 0; see aga aeglustab heterogeenset reaktsiooni.
Erinevalt keemiliselt reaktsioonist sõltub difusioon lahuses segamisest. Seega kui heterogeense protsessi kiirus sõltub segamise intensiivsusest, siis on difusioon selle protsessi kiirust määravaks staadiumiks.
Difusiooni kineetiline võrrand (tuletuskäik).
Fick'i I seaduse järgi määrab difusiooni teel ajavahemikus dt läbi ristlõikepinna s ülekantud ainehulga dn järgmine võrrand:
Vaatleme reageeriva aine difusiooni lahusest tahke keha
pinnale, kus kulgeb keemiline reaktsioon. Statsionaarse
protsessi korral on difusiooni kiirus võrdne keemilise
reaktsiooni kiirusega, aine pindkonts cS ei muutu
ning aine konts jaotumine eri lahusekihtides on ajast
sõltumatu. Stats dif korral muutub c lineaarselt
kaugusega x faaside eralduspinnalt, seega dc/dx = const. Muutuva kontsentratsiooniga tsoon ulatub lahuses kindla kauguseni , millest alates c enam ei muutu ja on võrdne lahuse konts c0 . Ülekanne toimub teatava paksusega nn difusioonilises kihis, kus konts grad on 0-st erinev. Avaldades Fick'i I sead dif kiiruse dn/dt pindalaühiku kohta:
Statsionaarse dif korral saab diferentsiaalid asendada lõplike muutustega;
Seega:
Mis ongi stats dif kineetiline võrr, mis määrab sellise heterogeense reakts kiiruse, mille limiteerivaks staadiumiks on difusioon.
Heterogeense reaktsiooni kiiruse kontsentratsioonist sõltuvuse avaldis (tuletuskäik) ning selle analüüs.
Heterogeense reaktsiooni keemilise staadiumi kiirus sõltub aine pindkontsentratsioonist:
Statsionaarses olekus peavad reaktsiooni eri staadiumide kiirused olema võrdsed:
Ühendades eri staadiumide kiiruste avaldised, saame:
Siit saab avaldada statsionaarse pindkontsentratsiooni faaside piirpinnal:
Asendame vk avaldises pindkontsentratsiooni tema avaldisega ning saame:
kus k on summaarse protsessi kiiruskonstant. Seega on antud reaktsioon reageeriva aine kontsentratsiooni c0 suhtes I järku.
Erinevate staadiumide kiiruste mõju summaarse protsessi kiirusele ning reageeriva aine pindkontsentratsioonile saab analüüsida nii, et esiteks korraldatakse ümber protsessi kiiruskonstandi avaldis:
ning võrrandist saab avaldada kiiruskonstantide suhte:
Kui kk >> kd (dif on aeglane) siis k kd ning cs << c0
Kui kk << kd (reakts aeglane) siis k kk ning cs c0
Võrdle heterogeense reaktsiooni difusioonistaadiumi ja keemilise reaktsiooni staadiumi kiiruse temperatuurisõltuvusi, kirjelda, kuidas see praktiliselt avaldub.
Difusiooni kiirus suureneb temperatuuri tõustes Arrheniuse võrrandile sarnase seaduspärasuse järgi
Kus Ed on dif aktiv. energia. Ed ületab harva 4000 – 8000 J/mool, mis on palju väiksem enamiku keemiliste reaktsioonide aktiveerimisenergiast. Seega temp kasvades suureneb dif kiirus aeglasemalt kui reaktsiooni kiirus.
Madalamatel temp on limiteerivaks keemiline staadium.
Kuna keem reakt kiirus kasvab temp tõustes kiiremini,
siis hakkab kõrgematel temp heterogeense reaktsiooni
kiirust limiteerima difusioon. Joonisel eksp kiiruskont
logaritmi sõltuvus 1/T-st etüüni oks reakts MnO2
pinnal. Ab vastab dif alale ja cd kin alale. Bd on üle-
mineku ala, mis on eriti märgatav reakts kulgemisel
poorse aine pinnal. See on tingitud sellest, et dif
protsessid tahke aine poorides on tunduvalt aeglasemad
kui reakts osavõtva aine ülekanne keha välispinnal. Seepärast võib välispinnal reaktsioon kulgeda kineetilises alas ja samaaegselt pooride sisepindadel reaktsioon kulgeda dif alas. Summaarselt kulgeb lähevad reaktsioonid poorsetel ainetel kin alast dif alasse üle järkjärgult.
Elektroodiprotsesside kineetika
Selgita, miks erineb töötava elektrokeemilise elemendi potentsiaal tema nullvoolupotentsiaalist.
Nullvoolupot määratakse tingimusel, et süsteemi ei tohi vool läbida. Seda tehakse, sest kui rakku vool ei läbi, töötab see pöörduvalt ja ainult pöörduvalt toimuvate protsesside tehtav töö on maks ning maks tööd saab seostada Gibbsi energiaga.
Kui rakku läbib vool, siis see ei tööta enam pöörduvalt ning raku töö pole maksimaalne ja seega ei saa seda seostada Gibbsi energiaga.
Elektroodide polarisatsioon
Töötava elemendi korral tekib elektroodidele pidevalt laengut juurde (näiteks elektrone voolab juurde katoodile) ja sõltub reaktsiooni kiirusest, kui kiiresti üleliigne laeng ära reageerib (kui kiiresti nt metallikatioonid elektrone katoodilt üles korjavad). Kui reaktsioon ei jõua üleliigset laengut likvideerida, siis elektroodipot muutub. Elektroodipot nihet tasakaalupot suhtes, mis toimub voolu läbi juhtimisel elektroodist nimetataksega polarisatsiooniks (elektrivoolust tingitud elektroodipot nihe).
Mida aeglasem on elektroodireaktsioon, seda kergemini polariseeritav on elektrood.
Võrdle nullvoolupotentsiaali ja tasakaalupotentsiaali. KÜS
SEE ON ÜKS JA SAMA ASI!!! kUID TASAKAALUPOT RÄÄGITASE 1 ELEKTROODI KOHTA, NULLVOOLUPO ON RAKU KOHTA, SEST POURBAIX ANNAVAD TASAKAALULISED POT, Elektroodi tasakaalupot nimetatakse pot, mille juures päri- ja vastassuunalise elektroodiprotsessi kiirused on võrdsed.
Nullvoolupot on pot, mille juures süsteemi vool ei läbi.
Kontsentratsioonipolarisatsioon (kontsentratsioonipolarisatsiooni avaldise tuletuskäik)
Polarisatsiooni, mis on tingitud difusiooni aeglusest ja sellega seotud konts muutumisest elektroodil, nimetatakse kontsentratsioonipolarisatsiooniks.
Vaatleme metallkatoodil kulgevat metalli sadenemise el keem protsessi
Mida suurem on süsteemi läbiv alalisvool, seda kiiremini toimub elektroodireaktsioon ning alates mingist voolu väärtusest alates ilmneb konts pola, sest ioonide ülekande kiirus lahusest pinnale on väiksem nende ärakasutamise kiirusest elektroodireaktsioonis. Kontsentratsiooni vähenemine elektroodi pinnal vähendab elektrokeemilise reaktsiooni kiirust ning suurendab ioonide elektroodile difundeerumise kiirust (sest kontsentratsioonigradient suureneb). Teatava aja möödumisel saabub statsionaarne olek, ehk difusiooni kiirus saab võrdseks reaktsiooni kiirusega. Ioonide pindkontsentratsioon cs jääb konstantseks ja difusiooni kiirust väljendab võrrand
Dif kiirusest saab määrata difusioonivoolu tihedust j (elektroodi läbiva voolu tugevust pinnaühiku kohta). Stats olekus määrab I/(t*S) difundeerunud ioonide hulk. Voolutiheduse j leidmiseks tuleb seega difusiooni kiirus vd korrutada iooni laenguga z ja Faraday arvuga F:
dif voolu tihedus on võrdeline ioonide kontsentratsioonide erinevusega lahuses ja metalli pinnal. Teatava c0 väärtuse korral on j max, kui ioonide kontsentratsioon elektroodil (cs) on langenud nullini. Maksimaalset voolu, mida elektroodist antud elektroodireaktsiooni kulgemise korral saab läbi juhtida, nimetatakse piiriliseks difusioonivooluks id:
Elektroodipotentsiaal sõltub ioonide kontsentratsioonist elektroodi pinnal vastavalt Nernsti võrrandile:
Elektroodipotentsiaali muutus ΔE elektrivoolu toimel on seega avaldatav järgmiselt:
Difusioonvoolu ja piirilise difusioonivoolu avaldistest saame avaldada suhte cs/c0:
asetades selle ΔE avaldisse, saab kontsentratsioonipolarisatsiooni võrrandi:
Elektrokeemiline polarisatsioon ehk ülepinge. Butler-Volmeri võrrand (tuletuskäik). Erijuhud madalatel ja kõrgetel ülepingetel. Tafeli ja Butler-Volmeri võrrandi võrdlus. KÜS--- ÜKS ON TEISE PIIRTINGIMUS
Kui süsteem on tasakaaluolekus, siis on otse- ja
pöördreaktsioonide kiirused võrdsed ning vastavat
voolutihedust nimetatakse vahetusvooluks:
j0 = jotse = jpöörd Summaarset reaktsiooni ei toimu,
j = 0 ja η = 0. (kõver 1) Rakendadades süsteemile
sellist ülepinget, et otsereaktsioon hakkab toimuma
kiiremini kui pöördreaktsioon, siis saab kõverale 2. Reaktsiooni energiamuut muutub suuruse Fη võrra, kuid nagu see energiamuut jaotub otse- ja pöördreaktsiooni aktiv energiate vahel ära. Suurust α nimetatakse ülekandekoefitsiendiks.
Olgu oksüdeerija Ox ja reduteerija Red (z(ox, red) = +/- 1). Anoodprotsessi kiiruse väljendada kujul:
Katoodprotsessi kiirus:
Kiirus- ainehulk, mis tekib elektroodi pinnaühiku kohta ajaühikus, produkti voog. Seega vastav voolutihedus saadakse, korrutades kiiruse Faraday arvuga
(Anoodvool- positiivne) Elektroodi läbiv voolutihedus on anood- ja katoodvoolu vahe:
(Kui elektroodil toimub eelistatult oksüdeerumine, siis ja > jk, j > 0 ja elektroodi läbib anoodvool.) Aktiveeritud vahekompleksi teooria põhjal võib nii otse- kui ka pöördreaktsiooni kiiruskonstandi avaldada kujul:
kus B on konstant. Kiiruskonstandid asetatakse j avaldisse:
Aktiveeritud vahekomplekside energiad saab avaldada lähtudes sellest, et kui elektroodi laeng on vrld lah sisemusega positiivne, siis tuleb Ox redutseerimiseks teha rohkem tööd (seega selle poolreaktsiooni energia kasvab)
ning asendame need voolutiheduse avaldisse ja saame:
kui η = 0 , siis ka j = 0, järelikult
Ning saab teha lihtsustusi:
2 ERIJUHTU:
Kui ülepinge on madal ( η umbes 0,01 V) siis << 1, saab kasutada rittaarendust
Siit saab avaldada ülepinge:
Seega on ülepinge sõltuvus voolutihedusest madalate ülepingete alas lineaarne. Kui j > 0, siis on ka ülepinge positiivne
Kui ülepinge on kõrge ja positiivne (elektrolüüseri anood), siis B-V võrr II liige on väga väike ning saame
ja log sõltuvusena:
Selle võrrandi saab teisendada Tafeli võrrandiks
Kui ülepinge on kõrge ja neg, siis B – V võrr I liige väga väike ning
logaritmilisel kujul:
NB! kogu tuletuskäik oli eeldusel, et tegu 1-laenguliste ioonidega, vastasel juhul tuleb F kõigis võrr- tes korrutada z-ga.
Selgita, kuidas mõjutab polarisatsioon galvaanelemendi ja elektrolüüseri potentsiaali.
KÜS KOHE KUI VOOL HAKKAB LÄBIMA, SIIS GALV ELEMENT KAOTAB TÖÖVÕIMES, KUI ELEKTROLÜÜSER SIIS EI PIISA TASAALUPOT, SIIS PEAB RAKENDAB ÜLEPINGET, EHK SELLEKS ET TEATUD KIIRUSEGA REAKTSIOONI SAADA, PEAB VOOLU JUURDE ANDMA (SEST SÜST TÖÖTAB MITTEPÖÖRDUVALT
Polarisatsioon vähendab elemendi töövõimet ehk alandab potentsiaali.
Polarograafia (millel põhineb ja millist informatsiooni annab).
Polarograafia on elektrokeemilise analüüsi meetod, mis põhineb metallide sadenemisel katoodil. Mõõdetakse voolutiheduse sõltuvust potentsiaalist (elavhõbe-tilk elektroodil sadenemine). Kindla pot juures sadenevad üht sorti metallikatioonid, pot tõustes jõuavad need ioonid difusioonlimiteeritud alasse ja voolutihedus pot tõustes enam ei kasva. Difusioonlimitatsioonile vastava platoo kõrgus sõltub selle iooni kontsentratsioonist lahuses, seega kalibreerimisgraafiku meetodi abil saab teada metall kontsentratsiooni. Puuduseks see, et elavhõbe on mürgine ja sellega töötamine on paljudes riikides keelatud.
Korrosioon ja korrosioonikaitse
Korrosioon on metallide elektrokeemiline oksüdatsioon näiteks hapniku toimel. Reaktsioon toimub elektrolüüdi lahuse juuresolekul, nt raud hakkab lahustuma el lüüdi lahuses lahustunud O2 toimel. Kusjuures anood ja katoodprotsessvõivad toimuda metalli pinna erinevatel osadel.
Praktikas on oluline korrosiooni vältimine või pidurdamine. Korrosiooni vältimiseks kasutatakse mitmesuguseid korrosiooni suhtes kindlaid katteid, näiteks värvimist. Mitmeid metalle saab passiveerida tugevate oksüdeerijate toimel. Passiivses olekus on metalli pind kaetud keemiliselt inertse
(näiteks kroom ja tsink).
Korrosiooni eest saab kaitsta ka elektrokeemiliste meetoditega. Anoodne kaitse seisneb selles, et metalli potentsiaal viiakse nii palju positiivsemas suunas, et katoodreaktsioon ei saa enam toimuda ning seetõttu ei toimu ka anoodreaktsiooni ehk korrodeerumist.
Katoodse kaitse korral muudetakse metalli pot nii palju neg-ks, et anoodreaktsiooni kiirus väheneb tunduvalt või muutub nulliks.
Samuti saab kaitstava metalli pot viia negatiivsemaks aktiivsemast metallist protektoriga, sel juhul eraldub küll H2, kuid lahustub protektor, mitte kaitstav objekt.
Elektrosadestamine ja –söövitamine
Elektrosadestamise meetodil valmistatakse metalldetailidele galvaanilisi katteid. Elektrosadestamise teel on keerukas valmistada keerukaid detaile, kuna sadenemise kiirus sõltub palju aluspinna ebatasasusest.
Küll aga on võimalik elektrosöövitamise teel valmistada ka väga väikeseid keerulisi metalldetaile. Elektrosöövitamise põhilised meetodid:
metalli pind kaetakse polümeeriga ning laseri abil hävitatakse kaitsekiht söövitamist vajavatelt osadelt. Sellele järgneb elektrokeemiline söövitamine.
Keerulise pinnaprofiili ning söövitamise erineva sügavuse korral rakendatakse vastava pinnaprofiiliga katoodi, mille abil söövitatakse anood, mille profiil kordab katoodi oma.
Elektrorafineerimine KÜS EI TULE, SEST POLE!!!
Pindnähtused
Pinna vabaenergia ja pindpinevus. KÜS SIIS RÄÄGITAKSE MITTETAHKETEST AINETEST, KUIDAS NEED OMAVAHEL SEOT ON
Vedelike korral on pindpinevus sama, mis pinna vabaenergia, ehk vedelik-vedelik, vedelik-gaas piirpindade korral iseloomustab see uue pinna moodustamiseks vajalikku tööd.
Tahkiste puhul nimetatakse pinna vabaenergiat pinna moodustumise pöörduvaks tööks
Pindpinevus on töö, mida tuleb teha piirpinna suurendamiseks 1 ühiku võrra.
Mis on pindpinevuse, pindrõhu, märgumise ja ja kapillaarsete nähtuste füüsikaline tagapõhi?
Pindpinevus: Vedela faasi sisemuses asetsevad molekulid toimivad naaberosakestega ühesuguse jõuga kõigis suundades ning seetõttu on nendele mõjuv resultantjõud võrdne nulliga. Faasi piirpinnal asetsevatel osakestel on vastastikune toime vaid faasipoolsel küljel, sest gaasiga vastastikmõju praktiliselt puudub (gaas on hõre), järelikult mõjub piirpinna osakestele jõud, mis on suunatud faasi sisemusse. Seetõttu püüab vedelik piirpinda vähendada ning piirpinna suurendamiseks ds võrra on vaja teha tööd dw, võrdeteguriks pindpinevus.
Pindrõhk: jällegi sama, et vedeliku pindkihi molekule mõjutavad gaasimolekulide tõmbejõud on väiksemad kui faasi sisemuse tõmbejõud. Seega on piki pinnanormaali mõjuv resultantjõud suunatud vedeliku sisemusse . See jõud pinnaühiku kohta ongi lahuse pindrõhk.
Märgumine: tilga kuju pinnal sõltub 3 pindpinevuse resultandist, kui tahkis-gaas pindpinevus on suurem kui [cos(nurk)*vedelik-gaas-pindpinevus + tahkis-vedelik-pindpinevus], siis märgab, vastasel juhul mitte.
Kapillaarnähtused esinevad, kuna nõguspinna kohal on madalam rõhk kui tasapinnal ning kumerpinna kohal suurem rõhk.
Miks püüab vedelikutilk võtta sfäärilist kuju?
Sellepärast, et tilk püüab saavutada võimalikult väikest eripinda, et vähendada pindrõhku, mille osatähtsus raadiuse väiksemaks muutudes suureneb.
Märgumine
.. nimetatakse protsesse, mis hakkavad kulgema 3 mitteseguneva faasi kokkupuutel piirpindadel ja mis vähendavad süsteemi energiat. Kui vedelik märgab tahket ainet, siis :
Kui vedelik ei märga tahket ainet, siis :
Kui äärenurk on võrdne 0-ga, siis on tegu täieliku märgumisega ja vedelik voolab laiali.
Laialivalgumistöö
Tilga kuju tahkise pinnal sõltub laialivalgumise töö suurusest. Laialivalgumise töö on süsteemi energiamuut, kui keha kattub vedelikukihiga.
Kui p ja T on konstantsed, siis
Kui vedelikukiht panna pinnale ja ta hakkab laiali valguma, siis st,g väheneb, st,v ja sv,g hakkavad kasvama. Seega ühikpinna korral
Vedelik valgub laiali, kui
Vedeliku siserõhu sõltuvus pinna kumerusraadiusest (tuletuskäik).
Olgu kera raadius algselt r. Suurendame kera nii, et tema raadius kasvab dr võrra ja pindala ds võrra:
Kuna dr2 on teiste liikmetega võrreldes väga väike, siis
Töö, mida tuleb teha kera pinna suurendamiseks:
Kuna dw = Fdr, siis järelikult F = Rõhk on jõud pinnaühiku kohta:
seega pindpinevusest tingitud rõhk ehk pindrõhk avaldub:
Kuna kõik jõud käivad sama pinna kohta, siis saame kirjutada kumerpinna rõhkude seose:
Rõhk vedelikutilga sees on pindrõhu võrra suurem kui välisrõhk. Nõguspinna korral on jällegi rõhk väiksem kui tasapinna kohal.
Kapillaarnähtused (tuletuskäik).
Kapillaarnähtused esinevad kapillaarides ja poorsetes kehades, milles pooride läbimõõt on võrreldav vedelikupinna kõverusraadiusega. Vedelikusamba rõhk (hüdrostaatiline rõhk):
Vedelikusammas kapillaaris tõuseb/langeb niikaua kuni vedelikusamba hüdrostaatiline rõhk kompenseerib kapillarrõhu ehk pindrõhu:
See kehtib hästi vedeliku ja gaasi vahelise piirpinna korral (vedeliku tihedus on palju suurem kui gaasi tihedus), kui on tegemist kas täieliku märgumise või täieliku mittemärgumisega. Osalise märgumise või mittemärgumise korral tuleb arvestada märgumisnurka
Kui on tegemist kahe vedeliku piirpinnaga kapillaaris, siis on nende tihedused võrreldavad ja valem näeb välja selline:
Kapillaarse kondensatsiooni võrrand (tuletuskäik).
Avaldame valemid aururõhu arvutamiseks, kui tegemist ei ole tasapinnalise piirpinnaga. Olgu p0 vedeliku aururõhk vedeliku tasapinna kohal ning p sama vedeliku aururõhk tilga kohal, mille raadius on r. G energia muutus ainehulga ühe mooli üleviimisel kondenseeritud faasist dispergeeritud faasi on avaldatav järgmiselt:
Gibbsi energia muudu dispersiooniastme muutumise tõttu saab avaldada ka termodünaamika I ja II seaduse kaudu ( ). Kui temperatuur ei muutu, siis:
Kuna ruumala ei ole siin rõhu vaid tilga raadiuse funktsioon, siis saame avaldise kirjutada lõplike muutuste kaudu:
Võrdsustame kahe dGm võrrandi paremad pooled:
Asendame pindrõhu võrrandist
See ongi kapillaarse kondensatsiooni võrrand, mis iseloomustab aururõhu muutust pinna kumeruse kasvades.
Selgita, miks ja kuidas erineb aururõhk kumer- ja nõguspindade kohal aururõhust tasapinnalise vedeliku kohal.
Vedeliku aururõhk kumerpinna (nt tilga) kohal on suurem kui tasapinna kohal:
Aururõhk nõguspinna kohal (nt vedelikus asuvas gaasimullis) on väiksem kui tasapinna kohal:
See on nii sellepärast, et nõguspindade korral on pindrõhk suunatud vedelikust välja, kumerpinna korral vedeliku sisse, KÜS- SEE ON FÜÜSIKALINE MUDEL, PÄRAST, VÕIB IKKA JOONUISTADA SELLE SELETADA LÄBI joonis.
Selgita, miks ja kuidas sõltub vedeliku pindpinevus temperatuurist ning lisanditest.
TEMPERATUUR: Pindpinevuse temperatuurisõltuvuse tuletamiseks kasutame Gibbsi energia avaldist
Kui rõhk ei muutu, siis dG = -SdT Kui ka pindala on konstantne , siis dG = sdσ
Võrdsustame saadud võrrandite paremad pooled
Kuna entroopia on alati positiivne, siis järelikult peab pindpinevus temperatuuri tõustes vähenema
LISANDID: Kahe- ja enamakomponentsetes süsteemides ei pruugi faasi komponentide kontsentratsioonid lahuse sisemuses ja piirpinnal olla samad. Toimub aineosakeste ümberjaotumine piirpinna ja faasi sisemuse vahel. Pindkihti saavad koguneda ained, mis vähendavad süsteemi pindpinevust. Sellist nähtust nimetatakse adsorptsiooniks ning piirpinnale kogunevaid aineid nimetatakse pindaktiivseteks aineteks ehk pindisteks. Pindaktiivsed ained vähendavad pindpinevust, pindinaktiivsed suurendavad pindpinevust.
Lahustuvuse sõltuvus dispersiooniastmest.
Kelvini võrrandile analoogiline võrrand kehtib ka lahustumise kohta
kus cd on lahustuvus, kui osakeste raadius on väike, ning c0 on tasakaaluline lahustuvus. Võrrandist on näha, et dispersiooniastme kasvades suureneb ka lahustuvus.
Pindpinevuse nääramise meetodid.
selle töö vahetu mõõtmine, mis on vajalik õhukese vedelikukile pinna ühikuliseks suurendamiseks (näiteks liikuva küljega raami abil).
rõhu määramine, mida tuleb rakendada selleks, et suruda gaasi- või vedelikumullike peenest kapillarist välja uuritavasse keskkonda
kindla vedelikuhulga peenikesest kapillaarist väljavoolamisel tekkivate tilkade arvu ja kaalu määramine (stalagmomeetriline meetod)
vedeliku kapillaarsuse tõusu mõõtmine
Adsorptsioon
Adsorptioon. Adsorptsioonientalpia, adsorptsiooni tasakaalukonstant ja Gibbsi vabaenergia.
Adsorptsiooniks nimetatakse aineosakeste iseeneslikku kogunemist pindkihis, mille tulemusena aine kontsentratsioon pindkihis ületab aine kontsentratsiooni faasi sisemuses.
Adsorptsiooniprotsess allub TD seadustele.
dG= dH – TdSs
Adsorptsiooniprotsessi käigus entroopia üljuhul väheneb (dS < 0), sest osakeste liikumise vabadusastmete arv väheneb. Kuna aga protsess on isevooluline, siis dG peab olema sel juhul negatiivne ning järelikult dH peab olema negatiivne.
Seega adsorptsiooniprotsess on üldjuhul eksotermiline protsess, st adsorptsiooni soojusefekt on negatiivne (adsorptsioonisoojus).
Adsorptsioonitasakaalu korral konstantse pinnatäituvuse tingimustes kirjeldab adsorptsioonientalpiat van’t Hoffi võrrand
Adsorptsiooni tasakaalukonstant on
Põhjenda, miks on adsorptsioonisoojus üldjuhul negatiivne. Millisel juhul võiks see olla positiivne?
Adsorptsiooniprotsessi käigus entroopia üljuhul väheneb (dS < 0), sest osakeste liikumise vabadusastmete arv väheneb. Kuna aga protsess on isevooluline, siis dG peab olema sel juhul negatiivne ning järelikult dH peab olema negatiivne.
Seega adsorptsiooniprotsess on üldjuhul eksotermiline protsess, st adsorptsiooni soojusefekt on negatiivne (adsorptsioonisoojus).
See võiks olla positiivne kui entroopia protsessi käigus kasvaks.
Võrdle füüsikalist ja keemilist adsorptsiooni.
Füüsikalise adsorptsiooni aluseks on puhtalt füüsikalised nähtused (ei teki uusi keemilisi sidemeid)
adsorbeeruva aine e adsorbaadi väljatõrjumine lahusest
Van der Waalsi jõud adsorbaadiosakeste vahel
elektrostaatiline (ioonid elektroodidel)
Füüsikalise adsorptsiooni energia on suhteliselt väike – umbes 20 –40 kJ/mol. (On nii kõrgema kui ka madalama adsorptsiooni energiaga füüsikalise adsorptsiooni juhtumeid.)
Keemiline adsorptsioon e. kemosorptsioon – tekib keemiline side adsorbaadi (adsorbeeruv aine) ja adsorbendi (pind millele adsorptsioon toimub) vahel. Side võib tekkida nii elektroni üleminekul kui ka ühise elektronpaari moodustamise teel. Tekib n.ö. pindühend. Kemosorptsiooni energia umbes umbes 200 kJ/mol.
Füüsikalise adsorptsiooni ja kemosorptsiooni erinevused
Kemosorptsiooni Gibbsi entalpia on suurem kui füüsikalise adsorptsiooni entalpia.
Keemilise sideme teke kemosorptsiooni käigus on seotud aktivatsioonienergiaga ja kulgeb seetõttu märgatava kiirusega kõrgematel temperatuuridel erinevalt
Füüsikalise adsorptsiooni tasakaal nihkub temperatuuri kasvades desorptsiooni suunas, keemilise adsorptsioon võib temperatuuri kasvades ka suureneda.
Kemosorptsioon on tavaliselt suuremal või vähemal määral mittepöörduv protsess, füüsikaline adsorptsioon pöörduv.
Kemosorptsioon on adsorbaadi suhtes selektiivne (sellepärast nimetatakse kemosorptsiooni sageli ka spetsiifiliseks adsorptsiooniks), füüsikaline adsorptsioon ei ole adsorbaadi suhtes selektiivne, kuigi adsorptsioonienergia teatud määral sõltub adsoraadist.
Kemosorbtsioon on monomolekulaarne – annab monokihi. Füüsikaline adsorptsioon võib olla nii monomolekulaarne kui ka polümolekulaarne.
Füüsikalise adsorptsiooni korral taastub adsorbent pärast adsorbaadi desorbeerumist endisel kujul, kemosorptsioonil tekkinud pindühendid ei pruugi adsorbaadi pinnalt lahkuda ja sel juhul adsorbendi pind endisel kujul ei taastu.
Gibbsi pindliig, pindkontsentratsioon, pinna täitumisaste.
Gibbsi adsorptsiooniks e. Gibbsi pindliiaks Γ nimetatakse aine hulka, mis tuleb süsteemile lisada või süsteemist ära võtta, et aine kontsentratsioon lahuse sisemuses jääks samaks, kui pindala suureneb 1 cm2 võrra.
Pindliig näitab aine liiga või puudujääki võrreldes faasi sisemusega. Kui pindkontsentratsioon on alati positiivne (teoreetiliselt võib ka null olla, st faasi pinnal ainet ei ole), siis pindliig võib olla nii positiivne kui ka negatiivne.
Pinna täitumisaste näitab, kui suur osa adsorptsioonitsentritest on adsorbaadi poolt hõivatud.
Kas pinna maksimaalne täitumisaste tähendab, et kogu pind on adsorbaadiga kaetud?
Ei tähenda, tähendab hoopis seda, et kõik võimalikud adsorptsioonitsentrid on adsorbaadi poolt hõivatud.
Adsorptsioon õhk-vedelik-piirpindadel.
Seda kirjeldab Gibbsi adsorptsiooniisoterm KÜS ÕHK VEDELIK PIIRPINDADEL ADS HÄSTI ORRG AINED, VAATLEME SEDA, MIS ADS VEDELIKU POOLT, VÄLJENDA, ET G ADS ON SUHTELINE SUURUS
Gibbsi adsorptsiooniisoterm (tuletuskäik), pindaktiivsus.
Vaatleme lahust, mis koosneb lahustist ja lahustunud ainest. Oletame, et tekib piirpind lahuse ja gaasifaasi vahel. Eeldame, et algmomendil on komponentide kontsentratsioonid faasis ja piirpinnal samad. Kui eeldada, et rõhk ja temperatuur ei muutu, siis saab Gibbsi vabaenergia muudu, mis on tingitud komponentide teatud hulkade üleminekul faasi seest piirpinnale, avaldada termodünaamika aluste põhjal järgmiselt:
kus dn1 ja dn2 on esimese ja teise komponendi e solv ja lah aine hulgad tekkinud piirpinnal ning μ1 ja μ2 keemilised potentsiaalid. Lisame siia pindpinevusest tingitud töö:
kus ds on tekkinud piirpinna suurus ja σ pindpinevus. Samal ajal saab täisdiferentsiaali omaduste põhjal kirjutada seose
Kuna võrrandite vasakud pooled on võrdsed, siis peavad ka paremad pooled võrdsed olema, millest järeldub, et
Jagame pindalaga ja saame:
Enamasti on keerukas määrata aine pindkontsentratsiooni, sellepärast asendatakse ainehulk ni aine hulga muutusega pindkihis dni:
kus ni 0 tähistab ainehulka piirpinnal, kui aine i kontsentratsioon piirpinnal ei erineks kontsentratsioonist lahuses, ning ni on sama aine hulk piirpinnal, kui teatud osa ainest on läinud lahusest piirpinnale (või sealt lahkunud). Γi on aine i Gibbsi adsorptsioon ehk pindliig.
Üldjuhul, kui pindpinevust mõjutavaid aineid on rohkem, siis
Kui uuritav lahus on lahja, siis saame teha mõned lihtsustused.
Eeldame, et lahusti pindliig Γl = 0 ( ) ning sel juhul saame seostada pindpinevuse vaid lahustunud aine pindliiaga
Lahjade lahuste korral võib keemilise potentsiaali avaldada kontsentratsiooni kaudu
Kui T ei muutu, saame keemilise potentsiaali avaldise diferentseerida lnc2 järgi:
Asendame võrrandis dμ2 ning saame lahustunud aine kontsentratsiooni seose tema pindliiaga:
Madalate kontsentratsioonide korral saab teha lihtsustuse: d lnc ≈ dc/c ja saame Gibbsi adsorptsiooni võrrandi:
Suurust nimetatakse pindaktiivsuseks ja see näitab pindpinevuse sõltuvust kontsentratsioonist
Adsorptsioon tahkistel. Uue pinna moodustumise pöörduv töö. KÜS
Vedelik-vedelik- ning vedelik-gaas-piirpindade korral iseloomustab uue pinna moodustamiseks vajalikku tööd pindpinevus ehk pinna vabaenergia, st vedelike korral pindpinevus = pinna vabaenergia. Tahkiste korral ei ole pindpinevus ja pinna vabaeneriga üks ja seesama. Tahkise lõhkumiseks tuleb lõhkuda sidemeid ja see nõuab energiat. Kui lõhestamine toimub pöörduvalt, siis energia jäävuse seause alusel salvestub kogu kulutatud energia uues pinnas. Seega võiks pinna vabaenergia olla võrdne poolega kohesioonienergiast (kui teised tingimused = konst). Tegelikkuses kehtib see vaid vaakumis tekkinud värske pinna kohta. Tahkise pind muutub pärast tekkimist reorganisatsiooni- ja adsorptsiooniprotsesside tõttu, mis põhjustab ka pinnaenergia muutust. Pinna vabaenergiat nimetatakse seetõttu pinna moodustumise pöörduvaks tööks
KAS NII AINULT TAHKISTE KORRAL; KAS ISEL ENERGIAT; MIS JÄÄB PINNALE KUI SEE ON ADS RIKUTUD? PEENE SADE LAHUSTUB KIIREMINI, KUI JÄTTA SEISMA, SIIS PEENED KRISTALLID LAHUSTUVAD PAREMINI, SUUREMA HALVEMINI, SISI PEENELT SADEMELT SADENEB SUUREMALE KRISTALLILE TASAKAALUKONST JÄRGI MÄÄRATUD OLEK- LAHUSTUMISE TASAKAAL
Pinnadefektide ja –puhtuse mõju adsorptsioonile.
Pinnastruktuur on otseselt sõltuv kristallstruktuurist, võredefektidest ja pinna valmistamise viisist. Tahkise pind ei ole kunagi absoluutselt sile.
Erinevatel pinna-aatomitel on erinev arv sidemeid, seega on nende energiad erinevad, mistõttu adsorbeerub adsorbaat pinna eri osadele erineva tugevusega.
Normaalses olukorras saastub värskelt tekitatud kristallipind ülikiiresti. Selleks, et hoida pind puhtana
üritatakse tekitada värske pind kõrgvaakumis
pommitatakse gaasiioonidega (võib tekitada amorfse pinna)
kuumutatakse elektriliselt
Milleks on vaja adsorptsiooniisoterme ja kuidas neid kasutada?
Adsorptsiooniisotermid kirjeldavad adsorptsiooni tasakaalu. Nad seovad adsorbaadi täitumisastme (või pindliia) adsorbendil tema kontsentratsiooniga gaasigaasis või lahuses konstantsel temperatuuril. Konkreetse adsorptsiooniisotermi sobivus süsteemi kirjeldamiseks sõltub adsorptsiooni iseärasustest ja tugevusest, aga ka adsorbeeruvate osakeste omadustest.
Iga adsorptsiooniisotermi jaoks on tuletatud ka selle sirgestamise võrrand. Konkreetse protsessi uurimisel koostatakse erinevate isotermide järgi graafikuid ning kui leitakse sobiv isoterm, mille sirgestamise võrrand annab sirge sõltuvuse, siis on võimalik adsorptsiooniprotsessi iseloomustada – kas tegemist on nõrga või tugev adsorptsiooniga, mono- või polükihilise adsorptsiooniga, millised on adsorbaadi ja adosrbendi ning adsorbaadi osakeste omavahelised toimed
Langmuir’i adsorptsiooniisoterm eri juhtudel (gaaside adsorptsioon tahkistel, adsorptsioon lahuse ja tahke faasi piirpinnal, dissotsiatiivne adsorptsioon, konkureeriv adsorptsioon, Henry isotherm) (koos tuletuskäikudega).
Eeldused: adsorptsioon ei ületa monokihti; adsorbendi pind on molekulaarsel tasandil sile, puudub adsorbaadi osakeste vastastikune toime.
GAASIDE ADSORPTSIOON TAHKISTEL
Olgu adsorbendiga täitunud pinnaosa ? ja vaba pind (1-? ). Ads kiirus ehk ? muutus ajaühikus on võrdeline vaba pinnaosaga (1-?) ning adsorbeeruva gaasi rõhuga:
Desorptsiooni kiirus on järelikult võrdeline ?-ga:
Tasakaalu korral on need kiirused võrdsed:
ning ads tasakaalukonstant avaldub:
Sirgestamise võrrand:
st 1/ ? sõltuvus 1/p-st on sirge ning tõusust saab määrata ads tasakaalukonstandi.
LAHUSE JA TAHKE FAASI PIIRPIND
p asendatud adsorbaadi kontsentratsiooniga lahuses
Täitumisastme saab asendada G adsorptsiooni kaudu:
Sirgestamise võrrandid: või
DISSOTSIATIIVNE ADSORPTSIOON
Dissotsiatiivse asorptsiooni korral on side adsorbeerunud molekuli teatud osa ja pinna vahel piisavalt tugev, et on võimalik molekuli dissotsiatsioon adsorbeerumisel. Sel juhul hõivab iga dissotsieerunud aatom(irühm) adsorbendi pinnal ühe adsorptsioonitsentri. Kui 2-ks osaks, siis 2 tsentrit ja ads ning desorptsiooni kiirused:
ning täitumisaste:
Dissotsiatiivse ads isoterm on sirge ?-1 , c-1/2 koordinaatides.
KONKUREERIV ADSORPTSIOON
Kui kahe või enama aine osakesed adsorbeeruvad eelistatult samadel pinnaosadel, siis nad konkureerivad adsorptsioonitsentrite pärast. Olgu süsteemis kaks adorbaati A ja B ning vastavad täitumisastmed ? A ja ? B. Vaba pind on järelikult: 1 - ?A - ? B.
Adsorptsiooni kiirused:
desorptsiooni kiirused:
Ads isotermid on kummagi aine jaoks erinevad:
kus KA ja KB on vastavalt A ja B ads tasakaalukonstandid, neist võrr saab avaldada ?-d
kui A kontsentratsioon kasvab, siis B adsorptsioon väheneb ja vastupidi.
HENRY ISOTERM
Kui kontsentratsioon on väike (Kc << 1), siis lihtsustub Langmuiri isoterm Henry isotermiks
Dissotsiatiivse adorptsiooni korral avaldub Henry võrrand:
Adsorptsioonitsentrite aktiivsus, Freundlichi isotherm, Tjemkini isoterm.
Kui adsorptsioonitsentrid on erineva aktiivsusega, siis varieerub ka ads entalpia – täitumisastme suurenemisel ?Hads väheneb. Madalatel rõhkudel täidetakse vaid aktiivsed tsentrid, ning vähemaktiivsete tsentrite täitumisaste on null. Ka suurte täitumisastmete korral varieerub järelejäänud adsorptsioonitsentrite aktiivsus vähem.
Temkini istoerm eeldab, et ?Hads varieerub lineaarselt ning avaldub kujul:
kus A ja B on konst. Sirge võrr:
Freundlichi isoterm eeldab, et ?Hads muutub eksponentsiaalselt ning avaldub kujul
Sirge võrr:
Freundlichi isoterm kirjeldab süsteeme, kus adsorbendi ja adsorbaadi osakeste vaheline toime on nõrk, aga adsorbaadi osakeste omavaheline toime väga tugev.
Polükihiline adsorptsioon, BET isotherm. (tuletuskäiguga).
BET isoterm on Langmuiri isotermi laiendus, mis kirjeldab süsteemi, kus kemosorbeerunud monokihile lisaks adsorbeerub füüsikaliselt mitu lisakihti (nn polükihiline adsorptsioon). Eeldatakse, et I kihi ads iseloomustab ?Hads ning teiste kihtide moodustumist gaasi veeldumise ?H.
TULETUS: Adsorpts erinevate kihtidena võib väljendada rea tasakaaludega:
Kogu pinna vakantsid n kaetud erineva paksusega ads kihtidega. Osad vakantsid on täitmata, osad monokihiga jne.
Ads aine hulk pinnal:
nmono on max ainehulk I kihis. Kihtide ads
tasakaalukonst on väljendatavad järgm
kus p on gaasi rõhk. Esimese kihi täitumise tasakaalukonst on suurim, teised loetakse võrdseks kondensatsiooni tasakaalukonstandiga KL
kus pk on küllastusrõhk (millel gaas hakkab veelduma). Avaldame täitumisastmed tasakaalukonstantide avaldistest (3), asendame KL=1/pk ning asendame p/ps = z
Asendame ?2 ja kõrgemad ? võrr (2) ja viime ?1 sulgude ette:
Asendame ka ?1 tema avaldisega:
Asendame ka ?0 + ?1 + ?2 +... =1 analoog eelnenuga ?-d nende avaldistega.
Kuna p <k siis z on väga väike ning tegu on koonduva astmereaga, mida saab lihtsustada:
Ning võrr (6) saab kuju: Selleks, et lihtsustada võrr (5), võtame (7) tuletise z järgi: Võrr (5) sulg on analoog
võrr (9) vasakpoolse suluga , => Avaldame võrr (8) ?0 ning
asendame selle võrr (10)
Korrutame-jagame suurust K1p KL -ga ning asendame murrujoone pealmise KL =1/pk (4)
kus C on ads ja kond tasakaalukonstantide suhe ehk polümolekulaarse ads tasakaalukonst. Ning asendame K1p võrr (11):
Gaaside moolide arvud saab asendada vastavate ruumaladega:
Ioonide adsorptsioon
Ioonide adsorptsioon ja elektriline kaksikkiht.
Elektrolüütide lahustest võivad tahketel pindadel adsorbeeruda ioonid, mille tulemusena pind laadub kas „+“ või „-“. Seda ruumis lokaliseerunud laengut peavad kompenseerima vastasnimelised laengud, et säiluks elektroneutraalsus. Selliselt piirpinnale moodustunud laengulist struktuuri nimetakse elektriliseks kaksikkihiks. Kui adsorbendiks on laetud elektrood, siis katioonid adsorbeeruvad üldiselt neg ja anioonid pos elektroodil. Osad ioonid on võimelised ads -ma ka samanimeliselt laetud elektroodil. (nim spetsiifiliseks ads, mingi muu toime kui el staat tulemus).
Võrdle elektrilist kaksikkihti kirjeldavaid mudeleid (Helmholtzi, Gouy-Chapmani, Sterni ja Graheme’i teooriad). KÜS
HELMHOLTZ
Eeldatakse, et el 2kiht koosneb kahest paralleel asetsevast vastasmärgiliste laengute kihist, mis asuvad teineteisest umbes lahusti molekuli diameetri kaugusel: so laengute kihist metalli pinnal ja pinna lähedale tõmmatud ioonide kihist. Eeldati, et laeng nendes kihtides on ühtlaselt laiali jaotatud.
Eelis: küllaltki hea kooskõla eksp andmetega
Puudus: vaatleb ainult ioonide ja metalli vastastikust toimet ning ei kirjelda elektroodi mahtuvuse C ja laengu q sõltuvust temperatuurist, elektrolüüdi kontsentratsioonist, elektrolüüdi iseloomust, pindaktiivse lisandi olemasolust lahuses..
GOUY – CHAPMAN
Arvestab ioonide soojusliikumist. Eeldatakse, et elektriväli el 2kihis on kirjeldatav Poissoni võrrandiga (ühtlaselt jaotunud?); osakeste jaotus el 2kihis allub Boltzmanni võrrandile kus ci0 on i-nda osakese konts lah sisemuses, ci on osakese konts teatud kaugusel x elektroodi pinnalt, wi- 1 mol osakeste lah sis el 2kihti üleviimiseks tehtv töö, eeldatakse, et see töö on el staat töö:
Puudused:
Poissoni võrr eeldab et el väli on el 2kihi piires pidev ja pot on võimalik määrata igas välja punktis. Reaalsetes süsteemides on el välja tugevus ebaühtlane, sest ioonid on kindlate mõõtmetega (mitte punktid). Sp on G–Ch rakendatav vaid lahjades lahustes
wi sis peale el staat ka teisi jõude, mida G-Ch teoor ei arvesta, nt spetsiifilist adsorptsiooni põhjustavaid jõude.
Ei arvestata tööd lahusti väljatõrjumiseks el 2ihist lahuse sisemusse.
Ei arvestata ioonide vastastikust toimet, mis on seotud steeriliste faktoritega elektrilises kaksikkihis.
Ei arvestata ioonide solvat ja solvaatkatete deform osakeste sisenemisel el 2kihti
ei võimalda selgitada ioonide spets ads nähtusi; erineb tunduvalt eksp andmetest
Eelised:
võimaldab kvalitatiivselt iseloom paljusid eksp efekte ja määrata erinevaid parameetreid
STERN
Kombinatsioon Helmholz ja G-Ch. Põhiseisukohad:
met pinnalaegu kompenseeriv ioonide laeng koosneb 2 osast: tiheda kihi ioonide laengust ja difuusse kihi ioonide laengust.
Tiheda kihi ioonid asuvad met pinnast keskm kaugusel, mis võrdub ioonide raadiusega.
Difuusse kihi tsentrid asuvad elektroodist kaugemal kui r ja nende sum laeng on q1
Eelis:
annab võimaluse seletada ka 2kihi ümberlaadumisefekti (tihedas kihis võib olla mõlema laenguga ioone)
Puudus
kui spets ads ei toimu, siis tihedas kihis asuvate ioonide laeng erineb 0-st
GRAHAME- SPETS SIDEMEKS TULEB ÄRA LÕHKUDA 2 SOLVAATSIDET
Täiendab Sterni, jagab tiheda kihi 2 osaks, millest sisemine moodustub spets ads ioonidest ja välimine solvateeritud ioonidest.
Disperssed süsteemid ja kolloidsüsteemid
Disperssete süsteemide pinnaenergia
Pihussüsteemi iseloomustab peenestusaste ja eripind. Peenestusastete δ on pöörvõrdeline pihusfaasi osakese diameetriga d; δ = 1 / d
Eripind on pihusfaasi osakeste pinna ja ruumala suhe: Se =S/V; w = σ*S = σ*Se*V
Siit järeldub, et mida suurem on dispergeeritud faasi eripind, seda suurem on pinnaenergia osakaal kogu süsteemi energias ning seda rohkem hakkab pinnaenergia mõjutama süsteemi omadusi
Võrdle tõelisi lahuseid, kolloidlahuseid ja jämedispersseid süsteeme.
| Omadus |
Jämedisperssed |
Kolloidid |
Tõelised e madalmol. lahused |
| Dispergeeritus |
Jah |
Jah |
ei |
| Faasilisus |
Heterogeenne |
Heterogeenne |
Homogeenne |
| TD tasakaalulisus |
Mittetasakaaluline |
Mittetasakaaluline |
Tasakaaluline |
| Kin püsivus |
Mittestabiilne |
Stabiilne |
stabiilne |
| Sedimentatsioon |
Jah |
Ei |
ei |
| Difusioon |
Ei |
Jah |
jah |
| Filtreerumine |
Ei |
Jah/ei (ei läbi ultrafiltreid) |
jah |
| Dialüüs |
- |
Ei |
jah |
| Läbipaistvus |
Hägune |
Opalestseeruv |
läbipaistev |
Võrdle molekulaarseid ja ioonseid kolloidosakesi.
Kolloidlahused on heterogeensed süsteemid, kus vedelas faasis mittelahustuva tahke faasi osakesed on nii väikesed, et ei sedimenteeru (setti pinnale/põhja) aja jooksul.
Molekulaarsetel kolloidosakestel pole laengut, tekivad kuna pika SV ahela ja fun rühmaga org molekulidel on energ kaslik moodustada vees kogumeid, kus SV ahelad on koos mitselli seespool ja polaarne fun rühm väljaspool. Molekulaarsete mitsellide korral peab lahuses olema saavutatud mitselli moodustumise kriitiline kontsentratsioon. Ioonsete kolloidosakeste tekkeks on vaja nö „suguluses“ elektrolüüdi liiga lahuses. Ioonsetel kolloidlahused juhuvad elektrit, neile on iseloomulik elektrokineetiline pot ja neid saab lahuse ioontugevust muutes lõhkuda.
Millest sõltub tekkiva ioonse kolloidosakese ehitus? Koosta teatud lahuse teisele lisamisel tekkiva kollidosakese valem.
Sõltub sellest, millist suguluses olevat elektrolüüti on lahuses liias.
Kirjelda erinevate faktorite mõju kolloidlahuste püsivusele. KÜS
Kolloidlahust lõhub:
Dispersioonikeskkonna temperatuuri tõstmine- tuuma moodustava aine lahustuvus kasvab
Lahusti lisamine, milles tuum lahustub.
Aine lisamine, millega reag moodustab tuum lahustuva aine- kolloid lahustub
Kolloidlahuse liitumist ehk koagulatsiooni soodustavad kõik faktorid, mis vähendavad elektrokineetilist potentsiaali. Ehk tuleks lisada koaguleerivat iooni
Neutralisatsioonilist koagulatsiooni kutsuvad esile muutused, mis vähendavad osakeste laengut määravate ioonide adsorptsiooni
Kontsentratsioonilise koagulatsiooni kaotab kolloidosake kk konts kasvamise tõttu oma dif kihi ja osakesed muutuvad ebastabiilseiks
Reasta küsimuses toodud katioonid või anioonid koaguleeriva toime kasvu/kahanemise suunas.
Elektrokineetiline potentsiaal.
ζ-potentsiaal on arvuliselt võrdne potentsiaali väärtusega
sellel kaugusel kolloidosakese pinnast, kus algab pihus-
keskkonna vedeliku liikumine kolloidosakese suhtes.
Selline kaugus on valitud, kuan kolloidosakesega vahetult
kontaktis olevad ioonide kihid on ads jõududega seotud
kolloidosakese külge ja osalevad soojusliikumises koos
kolloidosakesega. Dif kihis paiknevad ioonid võivad liikuda kolloidosakesest eraldi. Dif osa paksus sõltub lahuse konts . Kui c on liiga madal, siis võib kol os kasvada liiga suureks, tõukejõud liiga nõrgad, settib välja. Kui c liiga kõrge, surut dif osa kokku, ζ-potentsiaal saab = 0-ga (isoelektriline olek)- ka siis ebastabiilsed.
Lisandite mõju elektrokineetilisele potentsiaalile.
Kui lisatav el lüüt ei sisalda laengut määravaid ioone (ega nendega sarnaseid, indiferentne elektrolüüt). Adsorbsesse kihti ioone ei lähe ja pot ei muutu
Kui ei sisalda ka spets ads ioone, siis dif kiht surutakse kokku, el 2kihi paksus väheneb, ja ka el kin pot väheneb
Kui sis spets ads ioone, siis toimub kolloidosakese ümberlaadumine ja el kin pot saab vastupidise märgi, lisaks surutakse ka 2kiht kokku.
Lisatav el lüüt sis osakese laengut määravaid ioone või nendega sarnaseid ioone. Sellise elektrolüüdi lisamine mõjub kahel moel
Elektrilisse kaksikkihti läheb juurde laengut määravaid ioone ning φ suureneb
Elektrolüüdi lisam põhj dif kihi kokkusurumise (eriti suuremate lisandikoguste korral), el 2kihi paksus väheneb ja ka el kin pot väheneb
Kolloidsüsteemide stabiilsus ja seda mõjutavad faktorid. KÜS mOLEKULAARSET SAAB TEISE KOLLOIDSE LAHUSEGA STABILISEERIDA, ÜHES ON 2 VEDELIKKU, TEISES TAHKE-VEDELIK
Termodünaamiliselt on soodustatud piirpinna vähenemine (dG = σds). Dispersioonijõud põhjustavad osakeste liitumist (koagulatsiooni või kondensatsiooni). Seega peab kolloidsüsteemide püsimine olema seotud kollapseerumise kineetilise takistusega. Mitmed tegurid töötavad dispersioonijõudude vastu: näiteks võib kolloidosakese pinnal olla kaitsev kile, mis stabiliseerib pinda ja mis ei lase osakestel ühineda, kui nad põrkuvad. Kolloidosakeste pind võib laaduda ning samanimeliste laengute tõukumise tõttu on koagulatsioon või kondensatsioon takistatud. Kolloidlahused on termodünaamiliselt labiilsed, aga kineetiliselt stabiilsed.
Mõjutavad temperatuur, lahusti, lahuse kontsentratsioon eri elektrolüütide seisukohast.
Kolloidsüsteemide lagunemine (koagulatsioon ja dissolutsioon). KÜS
Koagulatsioon: disperssed osad liituvad. Seda soodustavad kõik faktorid, mis vähendavad el kin potentsiaali.
VASTASPROTSESS: Dissolutsioon: kolloidosakeste lahustumine dispersioonikk, seda soodustavad kõik faktorid, mis suurendavad rasklahustuva tuuma lahustuvust (temp tõstmine, lahusti lisamine) või muudavad lahustuvaks (reageerimise teel)
Koagulatsiooni liigid.
Neutralisatsioonilise koagulatsiooni käigus kaotavad osakesed
oma laengu ning väheneb/kaob osakestevah elektrostaatiline
tõukumine. Kolloidosakese laeng väheneb siis, kui väheneb
üldine potentsiaalihüpe φ tema elektrilises kaksikkihis.
Joonisel os vah tõukejõu sõltuvused dif kihi paksusest
φ väheneb suunas kõveralt 1..3. Minimaalne kriitiline potentsiaal (kõver 3) on seot dif kihi paksusega δ: Kus D on dif koef. Kui φ on saavut kriit väärtuse, siis kaovad osakesi lahus hoidvad tõukejõud ning osakesed liituvad. Omane koll lah, millel on väike laeng. Kutsuvad esile muutused, mis vähend laengut määrav ioonide adsorpts
Kontsentratsioonilise koagulatsiooni korral kaotab kolloidosake kk c kasvamise tõttu oma dif kihi (surut kokku) ning os muutuvad ebastabiilseteks. Isel kol lah, mille osakesed on kõrge laenguga.
Pihussüsteemide elektrokineetilised nähtused.
Esinevad kui
rakendada disperssele süsteemile potentsiaaligradient, mis põhjustab os liikumist
osakeste liikumise tõttu tekib süsteemis potentsiaalihüpe.
ELEKTROKINEETILISED NÄHTUSED
Elektriväli põhjustab Faaside ümberpaiknemine
faaside ümberpaiknemist tekitab pot erinevuse
Liigub Liigub Liigub Liigub
vedel faas tahke faas tahke faas vedel faas
Elektroosmoos Elektroforees Settimispot Voolamispot
Elektroforees: dispersse faasi osakesed liiguvad välise välja toimel.
Elektroosmoos: keskkond liigub disp faasi suhtes
Mõlemad on seda kiiremad, mida suurem on rakendatud potentsiaal ja keskkonna dielektriline läbitavus ning mida madalam on keskkonna viskoossus.
Settimispotentsiaal: suspensioonides ja emulsioonides tekib pihusfaasi settimise tulemusel süst eri kõrgustel pot erinevus.
Voolamispotentsaal: tekib poorse membraaniga eraldet 2 suspensiooni vahel, vedeliku surumisel läbi membraani.
Kolloidlahuste puhastamise meetodid.
DIALÜÜS: on kolloidlahuse puhastamine madalmolekulaarsetest lisanditest. Dialüsaatoris on kolloidlahus puhtast lahustist erandatud poolläbilaskva membraaniga, mida läbivad kolloidlahuses sisalduvad madalmol osakesed, kuid mitte kolloidosakesed. Dialüüs on seda kiirem, mida suurem on lisandi konts grad kol lah ja lahustis. Sp pannakse lahusti tavaliselt voolama.
ELEKTRODIALÜÜS: Enamasti on kolloidlahustes lisanditeks elektrolüüdid, ning sel juhul saab dialüüsi kiirendada elektrivälja toimel. Probleemiks on aga see, et elektriväljas võib toimuda kolloidosakeste ioonkatte lagunemine ning koagulatsioon.
FILTREERIMINE: Kolloidlahused läbivad tavalisi filtreid ning sp saab neid puhastada jämedisp lisanditest filtreerimise teel
ULTRAFILTREERIMINE: Selle meetodi korral kasutatakse väga peenikeste pooridega membraane, mida kolloidosakesed ei läbi. Protsessi kiirendamiseks rakend kol lah rõhku, mille tulemusel väiksemad osakesed (lahustimolekulid ja elektrolüütide ioonid) filtreeruvad läbi membraani.
TSENTRIFUUGIMINE: Selle teel on võimalik pihusfaasi pihuskeskkonnast eraldada.
Homogeenne ja heterogeenne katalüüs
Kirjelda katalüüsi.
Keemiliste protsesside kiirenemist katalüsaatorite toimel nim katalüüsiks. Katalüsaator võtab ühel või teisel viisil osa keemilisest reaktsioonist, reaktsiooni lõpus taastuvad selle esialgsed keemilised omadused ja katalüsaatori hulk jääb muutumatuks.
Katalüsaator muudab vaid reaktsiooni kiirust. Kui reaktsioon ei saa TD toimuda, siis ei saa seda esile kutsuda ka katalüsaatori abil. Katalüsaator ei muuda termodünaamilist tasakaalu. Sellest järeldub, et katalüsaator mõjutab nii otse- kui ka pöördreaktsiooni kiirust ühtemoodi.
Homogeense katalüüsi mehhanism (sealhulgas katalüütilise reaktsiooni kiiruse avaldis tuletuskäigu ning piirjuhtudega).
Kui katalüsaator asub reagentidega samas faasis, siis on tegemist homogeense katalüüsiga.. Oletame, et ilma katalüsaatorita toimuks reaktsioon väga aeglaselt ja järgmise skeemi järgi:
Kus AB* on reakts aktiveeritud vahekompleks. Sama reaktsioon kat X manulusel toimub järgmise skeemi alusel:
Kus AX on vaheühend ja AXB* aktiveeritud vahekompleks. Reaktsiooni kiiruse määrab aktiveeritud kompleksi lagunemise kiirus:
Aktiveeritud vahekompleksi konts leidmiseks rakendame stats tingimust- eeldame, et reakts käigus akt vahekompl AXB* ja vaheühendi AX konts ei muutu:
Avaldame v-st (3) [AX]:
ning kasutame seda [ABX*] (v 2) ning reaks riiruse (v 1) avaldamiseks:
=>homogeense reakts kiirus on võrdeline katalüsaatori konts.
Piirjuhud: 1) Kui AX laguneb kiiresti lähteaineks ja reageerib aeglaselt ainega B, siis k-1>>k2[B] ja kiirus avaldub:
See on II järku reaktsiooni kiiruse avaldis, kus kiiruskonst sõltub kat konts (kuna selle c praktiliselt reakts käigus ei muutu, siis saab selle lisada konst hulka)
2) Kui AX reageerib kiiresti ainega B, siis k -1 << k2 [B]
See on I järku reakts kin võrr (reakts järk aine B suhtes =0) Eksp kiiruskonst on ka sel juhul võrdeline kat konts-ga.
Võrdle katalüsaatori ja inhibiitori toimemehhanismi.
Katalüsaator alandab reaktsiooni aktiviseerimisenergiat, inhibiitorid toimivad kas katalüsaatorimürgina (kui reakts toimub kat manulusel) või ründab/reageerib kiiresti reaktsiooni vaheühenditega (nt radikaalidega, kui need reakts vaheüh).
Inhibiitorid ei saa toimida reaktsiooni aktivatsioonienergiat tõstmise teel. Sel juhul ei toimuks reaktsiooni kiiruse vähenemist, sest reaktsioon toimuks ikka alternatiivselt väiksema aktivatsioonienergiaga teed mööda
Happelis-aluseline katalüüs (üldine ja spetsiifiline). KÜS- kui tohiks, jätaks selle võõra def alles, sest see on selgem- Stetsiifiline katalüüsi tekts algab „H+ ja oh näitel“ seega on justkui teisi spets happe-alus katalüsaatoried veel peale nende??? pealegi Brönstedi happed on ju ka justkui H+ seotud, siis on spets või...?
ÜLDINE happeline katalüüs tähendab prootoni ülekannet katalüsaatorilt reagendile:
S + HA → SH+ + A- järgneb SH+ reaktsioon. (N: estrite solvolüüs, keto-enool tautomeeria) ; (prooton antakse kiirust limiteeriva staadiumi käigus ära)
ÜLDINE aluseline katalüüs tähendab prootoni ülekannet reagendilt katalüsaatorile:
SH+ + HA → SH+ + A- Järgneb SH+ reaktsioon (N: org üh hologeniseerimine ja isomerisatsioon); (prooton võetakse kiirust limiteeriva staadiumi käigus juurde)
SPETSIIFILINE HAPPELIS-ALUSELINE KATALÜÜS
Spetsiifilises happe katalüüsis solvendis S, on reaktsiooni kiirus proportsionaalne protoneeritud solvendimol kontsentratsiooniga SH+. Happeline katalüsaator nihutab keemilist tasakaalu solvendi S ja happe AH vahel SH+ moodustumise suunas.
Prooton antakse enne ära, kui toimub reaktsiooni kiirust limiteeriv staadium.
Spetsiifilise happelis-aluselise katalüüsi kiiruskonstandi sõltuvus pHst (tuletuskäiguga).
Kui katalüsaatorina toimivad nii OH-- kui ka H3O+ ning reaktsioon võib samaaegselt kulgeda ka ilma katalüsaatorita, siis saab kineetilise võrrandi:
kh30 ja koh on hüdroonium- ja hüdroksiidioonide katalüütilised konst. Kuna katalüsaatori aktiivsus reaktsioonis ei muutu, saab I järku reaktsiooni kin võrrandi
Kui reaktsioon toimub tugevalt happelises kk, siis
on I ja II liige väheolulised ning reakts kiiruskonst
määrab põhiliselt H3O+ liige :
See võrr isel sõltuvuse 1 madala pH osa. Kui [H3O+]
väheneb, siis hakkab kiiruskonst määrama kat-ta
reakts kiiruskonst k0 ning reakts kiirus ei sõltu kk
pH-st. Kui [OH- ] kasvab, siis saab määravaks kiiruskostandi III liige:
Sellele võrr vastab sõltuvuse 1 kõrge pH osa tõusuga +1. Mida väiksem on kat-ta reakts kiirus (mida väiksem on k0), seda lühem on sõltuvuse horisontaalne osa (sõltuvus 2)
Kui kh30 on väga väike, saame sõltuvuse 3, kui koh on väga väike, siis sõltuvus 4.
Too näide spetsiifilisest ja üldisest happelisest katalüüsist.
Spetsiifiline happeline katalüüs: atsetaalide hüdrolüüs; sõltub otseselt pH-st, kui lisada puhvilahuses hapet, siis reaktsiooni kiirus ei muutu.
Üldine happeline katalüüs: ortoestrite hüdrolüüs. Kõik lahuses olevad happed on katalüsaatorid ja mõjutavad reaktsiooni.
Selgita happe-alus katalüütilise reaktsiooni kiiruskonstandi sõltuvust pH-st.
Soolaefekt (soolalisandi mõju happe-alus katalüütilisele reaktsioonile). KÜS
Soolaefektiks nim katalüütilise protsessi kiiruse suurenemist vastava happe soola lisamisel. Eristatakse primaarset ja sekundaarset soolaefekti. Primaarne soolaefekt on soola lisandist tingitud aktiivsuskoefitsiendi muutuse mõju reaktsiooni kiirusele. Sekundaarne soolaefekt on soola lisandi mõju reaktsiooni kiirusele reageerivate ainete
kontsentratsiooni muutuse kaudu.
Ensüümkatalüüs. Michaelis-Menteni mehhanism (Michaelis-Menteni võrrand tuletuskäiguga).
Ensüümid- valgud, mis katalüüsivad bioloogilisi protsesse. Ensüümkatalüüs on väga
spetsiifiline. Lähteaineid, mille reaktsiooni kiirust ensüüm mõjutab, nimetatakse substraatideks. Reaktsioonis võib osaleda üks, aga ka rohkem substraate.
Vaatleme reaktsiooni, kus osaleb substraat S ja ensüüm E, reakts tulemuseks on produkt P ning vabaneb E:
Reaktsiooni kiiruse e P tekkekiirus avaldub: Edasiseks analüüsiks rakendatakse ES kohta stats tingimust:
millest Viime konstandi k1 paremale:
Suurust Km nim Michaelise konstandiks. Saadud võrrandis asendame [E], arvestades
et kogu reaktsiooni vältel on vaba ensüümi E ja seotud ensüümi ES kontsentratsioonide
summa võrdne ensüümi algkontsentratsiooniga [E]0:
Kui substraadi c on suur, siis Km << [S] ning võrr lihtsustub:
st reaktsioon muutub substraadi suhtes 0-at järku reaktsiooniks ja kiirus saavutab max võimaliku kiiruse. Seetõttu nim vmax piirliseks kiiruseks. Tehes vastava asenduse kiiruse avaldises, saab Michaelis- Menteni võrrandi:
Heterogeenne katalüüs.
Reaktsioon toimub katalüsaatori pinnal, aktiveeritud vahekompleksid on adsorptsioonilised: reagent adsorbeerub katalüsaatoril ja moodustab elektroodi pinnaga seotud aktiveeritud vaheühendi. Katalüsaatoriks sobib see aine, millel konkreetne aktiveeritud vahekompleks adsorbeerub => heterogeenne katalüüs väga selektiivne. Mida suurem on katalüsaatori pind seda parem katalüsaator, sest seda rohkem reagenti mahub pinnale ja seetõttu on akt vaheühendit rohkem ja reakts tervikuna kiirem. Seetõttu sadestatakse katalüsaatorit tavaliselt poorsetele materjalidele või tekitatakse kat pinnale poorne kiht.
Heterogeense reaktsiooni ja heterogeense katalüüsi võrdlus. KÜS
Homogeense ja heterogeense katalüüsi võrdlus. KÜS
Heterogeenne katalüüs on selektiivsem kui homogeenne.
Katalüsaatorita ja katalüsaatoriga reaktsiooni võrdlus.
Katalüsaatorita reaktsiooni aktivatsioonibarjäär on kõrgem; ei pruugi üldse toimuda. Samas katalüsaator ei muuda reaktsiooni termodünaamiliselt, ainult kineetiliselt. Alg ja lõpp-produktid on mõlemal juhul samad, katalüsaatoriga tekivad teistsugused aktiveeritud vahekompleksid/ vaheühendid, mille energia on madalam. KÜS
Monomolekulaarne katalüütiline reaktsioon.
Lihtsamat monomolekulaarset pindreaktsiooni saab
kirjeldada Langmuiri adsorptsiooniisotermi abil.
Kui reagendi adsorptsioon pinnale on kiire ning
reaktsioon ise aeglane ja produkt desorbeerub kiiresti
pinnalt, on reaktiooni kiirus võrdeline täitumisastmega:
kus [R] on reagendi konts, k on reakts kiiruskonst ning K on adsorptsiooni tasakaalukonst . Kui [R] on suur (K[R] >>1), siis on reakts 0-t järku. Kui [R] on väike ( K[R] <<1), siis on reakts I järku.
Kui süsteemi on lisatud tugevalt tahkise pinnal ads-vat inhibiitorit, siis saab reagendi täitumisastme avaldada konkureeriva ads võrr alusel.
Kui produkti ads on võrreldav reagendi ads-ga, siis on produkt ise inhibiitoriks
Bimolekulaarne katalüütiline reaktsioon (Langmuir-Hinshelwoodi mehhanism ja Eley-Rideal’i mehhanism, võrrandite tuletuskäigud).
Langmuir-Hinshelwoodi mehhanism:
eeldab, et reaktsioon toimub A ja B molekuli vahel siis, kui nad adsorbeeruvad katalüsaatori pinnal naabertsentrites. Moodustub aktiveeritud vahekompleks ja see laguneb edasi produktideks:
Sellise reaktsiooni kiirus on võrdeline tõenäosusega, et A ja B satuvad naabertsentritesse, mis on võrdne kahe aine pinnatäitumisastme korrutisega.
Ning kiiruse jaoks saab järgmise avaldise:
Kui [B] = const, siis saab reakts kiiruse sõltuvuse
A konts väljendada ka graafiliselt. Kõigepealt
kiirus kasvab, sest kasvab A-B paaride hulk kat
pinnal. Max kiirus siis kui max arv A-B paare
Kui A konts veelgi suurendada, tõrjub A teise
reagendi pinnalt ära, A-B paaride hulk väheneb
ja ka reakts kiirus väheneb. A ja B madalate konts korral (KA[A]+KB[B] <<1) saame teist järku kin võrrandi:
Kui üks reagentidest (oletame, et A) adsorbeerub nõrgalt ja teine (B) tugevalt, siis
KB[B]>>1+KA[A] ning
mis näitab, et reakts sel juhul on I järku väheadsorbeeruva reagendi suhtes ning -I järku tugevalt ads-va reagendi suhtes.
Eley-Rideal’i mehhanism
... kirjeldab reaktsiooni, kus katalüsaatoril adsorbeerunud osake reageerib mitteads-nud osakesega. Näiteks gaasimolekul B põrkub gaasimolekuliga A, mis on ads-nud pinnal .
Sel juhul on produkti moodustumise kiirus võrdeline aine B osarõhuga pB ja adsorbeerunud gaasi A täitumisastmega katalüsaatori pinnal.
Kiiruskonstant on sellisel juhul palju suurem, kui mittekatalüüsitud protsessi korral, kuna
reaktsioon pinnal on madalama aktivatsioonienergiaga, sest adsorptsioon ise on tavaliselt ilma aktivatsioonibarjäärita või väga madala aktivatsioonibarjääriga. Kui adsorbeeruva komponendi A adsorptsiooniisoterm on teada, siis saab protsessi kiiruse
väljendada osarõhkude kaudu. Näiteks kui komponent A adsorbeerub vastavalt Langmuiri ads. isotermile, siis on kiirus avaldatav järgnevalt:
Kui A osarõhk pA on suur (juhul kui KpA >> 1), siis on peaaegu kogu kat pind täitunud komponendiga A ja kiiruse avaldis võtab kuju v=kpB st kiirust limiteerivaks on B osakeste põrkumine ads-nud ainega. Kui A on 2aatomiline molekul, mis dissotsieerub, siis tuleb rakendada dissotsiatiivse adsorptsiooni isotermi:
Võrdle heterogeense katalüüsi erinevaid mehhanisme (sarnasused ja erisused). KÜS
Katalüsaatori pinnaenergia ja struktuuri mõju katalüüsile.
Mida suurem on katalüsaatori geomeetriline ebaühtlus, seda suurem on katalüsaatori pind.
Heterogeenne katalüüs on enamasti väga selektiivne, st reaktsiooni katalüüsivad vaid selleks sobiva struktuuriga pinnaosad.
Kristallide pinnal võivad tekkida mitmesugused defektid, mille adsorptsiooniline aktiivsus on erinev, st pind on energeetiliselt ebaühtlane. Oletatakse, et adsorptsioon toimub eelistatult katalüsaatori aktiivsetes tsentrites, kus reaktsiooni aktiveerimisenergia on tunduvalt väiksem kui ülejäänud pinnaosadel. Suur defektide hulk võib reaktsiooniks sobivate pinnaosade hulka nii vähendada kui ka suurendada.
Lisandite mõju heterogeensele katalüüsile.
Katalüsaatori aktiivust mõjutab oluliselt lisandite esinemine kas katalüsaatoris või selle
pinnal.
Tihti on lisanditega katalüsaator aktiivsem kui puhas katalüsaator. Katalüsaatorit aktiveerivaid lisandeid, mis tekitavad aktiivseid tsentreid juurde, nimetatakse promootoriteks. Promootorid võivad suurendada ka katalüsaatori pinda.
Mida rohkem on katalüsaatori pind saastatud, seda halvemini ta enamasti töötab. Tahkise
pind ei ole kunagi ideaalselt puhas. Katalüsaatori pinna puhastamiseks on mitmeid võimalusi, kuid tuleb arvestada, et puhastusmeetodid võivad küll pinnalt lisandid eemaldada, kuid võivad ka vähendada aktiivsete tsentrite hulka pinnal. Ka temperatuuri tõsmine lisandite eraldamiseks katalüsaatorilt võib kõrvalnähuna katalüütilist aktiivsust vähendada.
Katalüsaatorimürgid on lisandid (tavaliselt lahusefaasis), mis adsorbeeruvad reagendi jaoks sobivates katalüsaatori piirkondades nii tugevalt, et blokeerivad need ja reaktsioon ei saa toimuda
Analüüsi, kas ensüümkatalüüs sarnaneb oma omadustelt rohkem homogeense või heterogeense katalüüsi omadustele?
Heterogeensele, kuna on väga selektiivne.
KÜS
